题目内容
在如图转化关系中,已知B、D都是淡黄色固体,请回答下列问题.
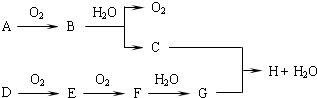
(1)写出下列物质的化学式:B ,G .
(2)写出下列反应的化学方程式:
A→B: ;E→F: ;B→C: .
(3)将过量气体E通入到下列各组溶液后,离子仍能大量共存的是 .
A.Ba2+、Ca2+、Cl-
B.OH-、CO32-、Na+
C.Ca2+、ClO-、Cl-
D.H+、Fe3+、NO3-.

(1)写出下列物质的化学式:B
(2)写出下列反应的化学方程式:
A→B:
(3)将过量气体E通入到下列各组溶液后,离子仍能大量共存的是
A.Ba2+、Ca2+、Cl-
B.OH-、CO32-、Na+
C.Ca2+、ClO-、Cl-
D.H+、Fe3+、NO3-.
考点:无机物的推断
专题:推断题
分析:常见淡黄色固体有Na2O2和S,其中能与水反应的为Na2O2,则B为Na2O2,A为Na,C为NaOH,则D为S,由转化关系可知E为SO2,F为SO3,G为H2SO4,与NaOH发生中和反应生成H为Na2SO4,结合对应物质的性质以及题目要求解答该题.
解答:
解:常见淡黄色固体有Na2O2和S,其中能与水反应的为Na2O2,则B为Na2O2,A为Na,C为NaOH,则D为S,由转化关系可知E为SO2,F为SO3,G为H2SO4,与NaOH发生中和反应生成H为Na2SO4,
(1)由以上分析可知B为Na2O2,G为H2SO4,故答案为:Na2O2;H2SO4;
(2)A→B的反应为2Na+O2
Na2O2,
E→F的反应为2SO2+O2
2SO3,
B→C的反应为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na+O2
Na2O2;2SO2+O2
2SO3;2Na2O2+2H2O=4NaOH+O2↑;
(3)E为SO2,可与OH-、ClO-、Fe3+、NO3-反应,则离子仍能大量共存的是A,故答案为:A.
(1)由以上分析可知B为Na2O2,G为H2SO4,故答案为:Na2O2;H2SO4;
(2)A→B的反应为2Na+O2
| ||
E→F的反应为2SO2+O2
| 催化剂 |
| 加热 |
B→C的反应为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na+O2
| ||
| 催化剂 |
| 加热 |
(3)E为SO2,可与OH-、ClO-、Fe3+、NO3-反应,则离子仍能大量共存的是A,故答案为:A.
点评:本题考查无机物的推断,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握常见物质的颜色,状态等特征,常为推断题的突破口,难度中等,注意相关基础知识的积累.

练习册系列答案
相关题目
取一定质量的下列各组物质混合后,无论以何种比例混合,其充分燃烧后二氧化碳和水的质量不变且二者物质的量相同的是( )
| A、C2H2 C6H6 |
| B、CH4 C3H8 |
| C、C3H6 C3H8 |
| D、C2H4 C4H8 |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、2.4g Mg与足量的盐酸反应,转移电子数为0.2NA |
| B、1.8g D2O(重水)中含NA个中子 |
| C、0.1mol OH-含NA个质子 |
| D、2.8g N2所含有的原子数目为0.1NA |
下列有关电池叙述不正确的是( )
| A、锌锰干电池是一种常用的二次电池 |
| B、氢氧燃料电池比火力发电的能量转变率要高 |
| C、锌锰干电池工作一段时间后锌外壳逐渐变薄 |
| D、碱性燃料电池正极反应是O2+2H2O+4e-=4OH- |
下列各组离子中,可以在某种澄清透明溶液中大量共存的是( )
| A、ClO-、Na+、H+、Cl- |
| B、Mg2+、Cu2+、Cl-、SO42- |
| C、Na+、Ba2+、Cl-、CO32- |
| D、K+、H+、Fe2+、NO3- |