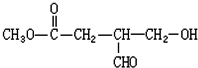
题目内容
下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是( )
| 元素 | X | Y | Z | W |
| 原子半径(nm) | 0.102 | 0.130 | 0.073 | 0.071 |
| 最高正价或最低负价 | +6 | +2 | -2 | -1,W无正价 |
| A、HW水溶液可以保存在玻璃瓶中 |
| B、X的单质与Z的单质反应生成XZ3 |
| C、Z的最高正价为+6 |
| D、原子序数X>Y>W>Z |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W四种短周期元素,X有最高正价+6,则X为S元素;Z有最低负价-2,则Z为O元素;W有最低负价-1,没有正化合价,则W为F元素;Y有最高价+2,原子半径大于S,则Y为Mg,结合元素周期律与元素化合物性质解答.
解答:
解:X、Y、Z、W四种短周期元素,X有最高正价+6,则X为S元素;Z有最低负价-2,则Z为O元素;W有最低负价-1,没有正化合价,则W为F元素;Y有最高价+2,原子半径大于S,则Y为Mg,
A.HF水溶液能与二氧化硅反应,可以腐蚀玻璃,不能保存在玻璃瓶中,故A错误;
B.硫与氧气反应生成二氧化硫,故B错误;
C.Z为O元素,没有最高正化合价,故C错误;
D.原子序数X(S)>Y(Mg)>W(F)>Z(O),故D正确,
故选D.
A.HF水溶液能与二氧化硅反应,可以腐蚀玻璃,不能保存在玻璃瓶中,故A错误;
B.硫与氧气反应生成二氧化硫,故B错误;
C.Z为O元素,没有最高正化合价,故C错误;
D.原子序数X(S)>Y(Mg)>W(F)>Z(O),故D正确,
故选D.
点评:本题考查原子结构与元素周期律关系,关键是根据化合价与原子半径推断元素,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、100℃时,pH=2的盐酸和pH=12的NaOH溶液等体积混合后,溶液为碱性 |
| C、pH=a的醋酸溶液加水稀释十倍后,溶液pH=a+1 |
| D、25℃时,用浓度均为0.1000mol/L的醋酸和盐酸溶液滴定等浓度NaOH溶液,二者pH突变范围相同 |
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A、8 g甲烷含有的共价键数约为NA |
| B、常温常压下,22.4 L二氧化碳原子总数为3NA |
| C、1 mol Fe与足量稀HNO3反应,转移3 NA个电子 |
D、3.2g硫(结构见图)含S-S键的数目为0.8NA |
下列有关化学用语正确的是( )
A、Na+的基态电子排布图是: |
| B、质量数之和比质子数之和大的水分子符号可能是:D218O |
C、Na2S的电子式: |
D、氯离子结构示意图为: |
某无色溶液中加入铝粉产生氢气,则该溶液中肯定能大量共存的离子是( )
| A、Na+、NH4+、SO42-、NO3- |
| B、Na+、K+、Cl-、SO42- |
| C、Fe3+、Mg2+、S2-、SO42- |
| D、K+、Na+、AlO2-、MnO4- |
28g铁粉与2.2g硫粉均匀混合,在密闭容器中加热,冷却后加入足量盐酸,在标准状况下收集到气体的体积是( )
| A、11.2L | B、5.6L |
| C、4.48L | D、2.24L |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、1L 1mol?L-1的NaClO溶液中含有ClO-的数目为NA |
| B、1mol的羟基与1mol的氢氧根离子所含电子数均为9NA |
| C、标准状况下,22.4L盐酸含有NA个HCl分子 |
| D、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA |
 如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是( )
如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是( )| A、洗气或干燥装置:瓶内放一定体积溶液,由a管口进气 |
| B、用于收集不溶于水的气体:瓶内充满水,由b管口进气 |
| C、提供少量CO:瓶内充满CO,b管口接自来水龙头 |
| D、H2S和SO2反应的装置:由a管口通入H2S,b管口通入SO2 |