题目内容
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、1L 1mol?L-1的NaClO溶液中含有ClO-的数目为NA |
| B、1mol的羟基与1mol的氢氧根离子所含电子数均为9NA |
| C、标准状况下,22.4L盐酸含有NA个HCl分子 |
| D、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.次氯酸钠溶液中次氯酸根离子部分水解,导致溶液中次氯酸根离子数目减少;
B.羟基中含有9个电子,氢氧根离子中含有10个电子;
C.标准状况下,盐酸的状态不是气体,不能使用标况下的气体摩尔体积减少盐酸的物质的量;
D.0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,转移了0.2mol电子.
B.羟基中含有9个电子,氢氧根离子中含有10个电子;
C.标准状况下,盐酸的状态不是气体,不能使用标况下的气体摩尔体积减少盐酸的物质的量;
D.0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,转移了0.2mol电子.
解答:
解:A.1L 1mol?L-1的NaClO溶液中含有溶质次氯酸钠1mol,由于次氯酸根离子部分水解,导致溶液中次氯酸根离子的物质的量小于1mol,含有ClO-的数目小于NA,故A错误;
B.1mol羟基中含有9mol电子,1mol氢氧根离子中含有10mol电子,二者含有的电子数不同,故B错误;
C.标况下盐酸不是气体,不能使用标况下的气体摩尔体积计算22.4L盐酸的物质的量,故C错误;
D.标准状况下,6.72L NO2的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,反应转移了0.2mol电子,转移的电子数目为0.2NA,故D正确;
故选D.
B.1mol羟基中含有9mol电子,1mol氢氧根离子中含有10mol电子,二者含有的电子数不同,故B错误;
C.标况下盐酸不是气体,不能使用标况下的气体摩尔体积计算22.4L盐酸的物质的量,故C错误;
D.标准状况下,6.72L NO2的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,反应转移了0.2mol电子,转移的电子数目为0.2NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项B为易错点,注意明确羟基与氢氧根离子的区别.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
下列基态原子的价电子构型中,正确的是( )
| A、3d94s2 |
| B、3d44s2 |
| C、3d54s24p3 |
| D、4d25s2 |
下列有机物中属于烃的是( )
| A、乙醇 | B、乙酸 | C、甲苯 | D、乙醛 |
下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是( )
| 元素 | X | Y | Z | W |
| 原子半径(nm) | 0.102 | 0.130 | 0.073 | 0.071 |
| 最高正价或最低负价 | +6 | +2 | -2 | -1,W无正价 |
| A、HW水溶液可以保存在玻璃瓶中 |
| B、X的单质与Z的单质反应生成XZ3 |
| C、Z的最高正价为+6 |
| D、原子序数X>Y>W>Z |
在理论上不能用于设计原电池的化学反应是( )
| A、Al(OH)3(s)+NaOH(aq)═NaAlO2(aq)+2H2O(l)△H<0 |
| B、CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H<0 |
| C、4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H<0 |
| D、H2(g)+Cl2(g)═2HCl(g)△H<0 |
除去苯中的少量苯酚杂质的通常方法是( )
| A、加水振荡,静置分层后用分液漏斗分离 |
| B、加NaOH溶液振荡后,静置分液 |
| C、加溴水振荡后,过滤 |
| D、加CCl4振荡后,静置分液 |
下列说法正确的是( )
| A、c(H+)=0.1mol/L的甲酸溶液中,HCOO-和H+ 数目之和为0.1 NA |
| B、通常情况下,溴是液态,碘是固态,所以I-I键比Br-Br弱 |
| C、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,2C(NH4+)=C(SO42-) |
D、合成顺丁橡胶( )的单体是CH2=CH-CH=CH2 )的单体是CH2=CH-CH=CH2 |

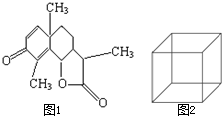 (1)图1是一种驱蛔虫药--山道年的结构简式,试确定其分子式为:
(1)图1是一种驱蛔虫药--山道年的结构简式,试确定其分子式为: