题目内容
已知RxO42-+MnO4-+H+→RO2+Mn2++H2O变化过程中,0.2mol RxO42-参加反应,共转移0.4mol 电子.
(1)反应的氧化产物为 .
(2)x= .
(3)参加反应的氢离子的物质的量为 .
(4)配平题中的离子方程式并将配平后的式子写在下面横线上: .
(1)反应的氧化产物为
(2)x=
(3)参加反应的氢离子的物质的量为
(4)配平题中的离子方程式并将配平后的式子写在下面横线上:
考点:氧化还原反应的计算
专题:
分析:RxO42-+MnO4-+H+→RO2+Mn2++H2O变化过程中,R元素化合价由+
价升高到+4价,Mn元素化合价由+7价降低到+2价,结合氧化还原反应中氧化剂和还原剂之间得失电子数目相等解答该题.
| 6 |
| x |
解答:
解:(1)R元素化合价由+
价升高到+4价,则R失去电子被氧化,对应产物RO2为氧化产物,故答案为:RO2;
(2)0.2molRxO42- 参加反应,共转移0.4mol 电子,则0.2mol×x×(4-
)=0.4mol,x=2,
故答案为:2;
(3)根据电子守恒配平后的化学方程式为5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O,当消耗5moR2O42-时,需要氢离子的物质的量是16mol,所以0.2 mol R2O42-参加反应时,反应的H+的物质的量为0.64mol,故答案为:0.64 mol;
(4)由电子、电荷守恒可知,离子反应为5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O,故答案为:5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O.
| 6 |
| x |
(2)0.2molRxO42- 参加反应,共转移0.4mol 电子,则0.2mol×x×(4-
| 6 |
| x |
故答案为:2;
(3)根据电子守恒配平后的化学方程式为5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O,当消耗5moR2O42-时,需要氢离子的物质的量是16mol,所以0.2 mol R2O42-参加反应时,反应的H+的物质的量为0.64mol,故答案为:0.64 mol;
(4)由电子、电荷守恒可知,离子反应为5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O,故答案为:5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O.
点评:本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意元素化合价的判断为解答该题的关键,从元素化合价的角度解答该类题目,难度不大.

练习册系列答案
相关题目
在相同条件下焚烧下列物质,污染大气最严重的是( )
| A、聚氯乙烯 | B、聚乙烯 |
| C、聚丙烯 | D、氢气 |
下列说法正确的是( )
| A、在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
| B、在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大 |
| C、加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体 |
| D、铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀 |
下列有关说法正确的是( )
| A、能在水溶液或熔融状态下导电的物质是电解质 |
| B、电离出氢离子的化合物是酸 |
| C、纳米材料也是一种胶体 |
| D、丁达尔效应可用来区别溶液和胶体 |
下列化肥在空气中放置一段时间后,肥效降低的是( )
①氨水 ②硫酸铵 ③碳酸氢铵 ④氯化钾 ⑤尿素.
①氨水 ②硫酸铵 ③碳酸氢铵 ④氯化钾 ⑤尿素.
| A、①② | B、①③ | C、③④ | D、②⑤ |
下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是( )
| A、实验室中用稀硫酸与锌粒反应制取H2 |
| B、实验室中用高锰酸钾加热分解制取O2 |
| C、实验室中用浓盐酸与二氧化锰加热制取Cl2 |
| D、实验室中用稀盐酸与石灰石反应制取CO2 |
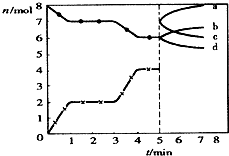 炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)?2CO(g)△H=QkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )
炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)?2CO(g)△H=QkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )A、0~lmin,v(CO)=1mol/(L?min);1~3min时,v(CO)=v(CO2);该反应的平衡常数表达式为k=
| ||
B、当容器内的压强不变时,该反应一定达到平衡状态,且
| ||
C、3min时温度由T1升高到T2,则Q>O,重新平衡时
| ||
| D、5min时再充入一定量的CO,c、b曲线分别表示n(CO)、n(CO2)的变化 |
据报道,上海某医院正在研究用放射性的一种碘12553I治疗肿瘤.该碘原子的核内的中子数与核外电子数之差是( )
| A、72 | B、53 | C、125 | D、19 |
