题目内容
13.X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.已知X的最外 层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大.Z和N可以形成ZN2型化合物.下列有关说法正确的是( )| A. | X 与 Y 只能形成一种化合物 | |
| B. | 单质的氧化性:X<M | |
| C. | 气态氢化物的稳定性:M>N | |
| D. | 最高价氧化物对应水化物的碱性:Y>Z |
分析 X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.X的最外层电子数是次外层电子数的3倍,X的最外层电子数为6,次外层电子数为2,可知X为O元素;X、M同主族,则M为S元素,N为Cl;Y在同周期主族元素中原子半径最大,则Y为Na元素,Z和N可以形成ZN2型化合物,则Z为Mg,然后结合元素周期律及元素化合物知识来解答.
解答 解:X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.X的最外层电子数是次外层电子数的3倍,X的最外层电子数为6,次外层电子数为2,可知X为O元素;X、M同主族,则M为S元素,N为Cl;Y在同周期主族元素中原子半径最大,则Y为Na元素,Z和N可以形成ZN2型化合物,则Z为Mg,
A.X、Y可形成氧化钠、过氧化钠,故A错误;
B.同主族从上到下非金属性减弱,则单质的氧化性:X>M,故B错误;
C.非金属性Cl>S,气态氢化物的稳定性:M<N,故C错误;
D.金属性Na>Mg,最高价氧化物对应水化物的碱性:Y>Z,故D正确;
故选D.
点评 本题考查原子结构及元素周期律,为高频考点,把握原子结构、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
4.一定量的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g),达到平衡后测得A气体的浓度为0.5mol•L-1,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为0.8mol•L-1,则下列叙述正确的是( )
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | B的物质的量浓度减小 | D. | C的体积分数降低 |
1.下列变化中,不需要破坏化学键的是( )
| A. | 加热氯化铵使其分解 | B. | 干冰气化 | ||
| C. | 食盐熔化 | D. | 氯化氢溶于水 |
8.如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
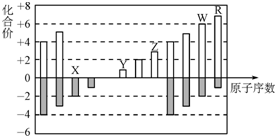

| A. | 离子半径:X>Y>Z | |
| B. | WX3和水反应形成的化合物是离子化合物 | |
| C. | 最高价氧化物对应的水化物酸性:R>W | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
2.在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的主要作用力依次是( )
| A. | 范德华力、范德华力、氢键 | B. | 范德华力、范德华力、共价键 | ||
| C. | 共价键、共价键、共价键 | D. | 范德华力、氢键、共价键 |
7. 生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
(1)已知:①2CH3OH(l)+3O2(g)﹦2CO2(g)+4H2O(g)△H=-1275.6KJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)由生物质能获得的CO和H2,可以合成多种有机物.当CO和H2以物质的量之比1:1进行催化反应,其原子利用率达100%,合成的物质可能是cd
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
①下列对该反应的有关说法不正确的是a
a.当v(CO)=2v(H2)时,该反应处于平衡状态
b.恒温恒压下,容器内气体的密度不再改变时,表明反应达到平衡状态
c.在原平衡体系中充入一定量的氦气,平衡可能发生移动
d.恒温恒压下,改变反应物的投入量,△H的值不发生变化
e.温度一定时,缩小容器的体积,平衡将向右移动,c(CO)将变大
②若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
下列判断正确的是ac.
a.c3>2c1=2c2
b.Q1+Q2=90.8 Q3=2Q1
c.K1=K2=K3
d.a2+a3<100%
(4)CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),一定温度下,在1L密闭容器中充入3molH2和3molCO进行反应,若用po表示该体系开始时的总压强,p表示平衡时的总压强,则平衡时CO的转化率为$\frac{3(p-{p}_{0})}{2{p}_{0}}$×100%(用po、p的式子表示)
(5)如图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+.
 生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.(1)已知:①2CH3OH(l)+3O2(g)﹦2CO2(g)+4H2O(g)△H=-1275.6KJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)由生物质能获得的CO和H2,可以合成多种有机物.当CO和H2以物质的量之比1:1进行催化反应,其原子利用率达100%,合成的物质可能是cd
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
①下列对该反应的有关说法不正确的是a
a.当v(CO)=2v(H2)时,该反应处于平衡状态
b.恒温恒压下,容器内气体的密度不再改变时,表明反应达到平衡状态
c.在原平衡体系中充入一定量的氦气,平衡可能发生移动
d.恒温恒压下,改变反应物的投入量,△H的值不发生变化
e.温度一定时,缩小容器的体积,平衡将向右移动,c(CO)将变大
②若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH平衡时浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | a1 | a2 | a3 |
a.c3>2c1=2c2
b.Q1+Q2=90.8 Q3=2Q1
c.K1=K2=K3
d.a2+a3<100%
(4)CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),一定温度下,在1L密闭容器中充入3molH2和3molCO进行反应,若用po表示该体系开始时的总压强,p表示平衡时的总压强,则平衡时CO的转化率为$\frac{3(p-{p}_{0})}{2{p}_{0}}$×100%(用po、p的式子表示)
(5)如图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+.
 按要求完成下列小题.
按要求完成下列小题.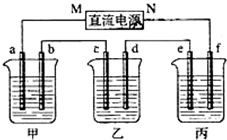 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.