题目内容
3.科学家曾预言一种可用作炸药的物质,分子式为C(N3)4,其爆炸反应方程式为:C(N3)4→C+6N2↑,下列说法一定错误的是( )| A. | 该物质为离子晶体 | |
| B. | 该物质可用通过C60吸附N2而制得 | |
| C. | C(N3)4中碳元素为正价 | |
| D. | 18g该物质完全分解可以产生13.44升(标准状况)氮气 |
分析 A.根据物质C(N3)4的微粒构成来确定所述的晶体类型;
B.C60吸附N2的过程是物理变化;
C.根据C、N得电子能力来确定价态的正负情况;
D.根据化学方程式结合Vm=22.4L/mol的使用条件进行计算.
解答 解:A.该物质由非金属元素构成,没有阴阳离子,故不为离子晶体,故A错误;
B.C和N之间存在共价键,不能是吸附作用的结果,故B错误;
C.C、N得电子能力:C<N,所以C显示正价,N显示负价,故C正确;
D.根据化学方程式,18g即0.1mol该物质完全分解可以产生0.6mol即标况下13.44升氮气,故D正确.
故选AB.
点评 本题考查较为综合,涉及晶体类型、氧化还原反应的判断、原子结构的判断,题目难度不大,把握氧化还原反应的规律,准确判断元素的化合价是解题关键.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
20.某强碱性溶液中含有的离子是K+、NH4+、A13+、AlO2-、CO32-、SiO32-、Cl-中的某几种,现进行如下实验:
①取少量的溶液用硝酸酸化后,该溶液无沉淀生成;
②另取一定量原溶液,逐滴加入盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变,后产生一种气体,最后沉淀逐渐减少至消失.
③另取一定量的原溶液中加入5mL0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g.
下列说法中正确的是( )
①取少量的溶液用硝酸酸化后,该溶液无沉淀生成;
②另取一定量原溶液,逐滴加入盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变,后产生一种气体,最后沉淀逐渐减少至消失.
③另取一定量的原溶液中加入5mL0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g.
下列说法中正确的是( )
| A. | 该溶液中一定不含K+、NH4+、A13+、SiO32- | |
| B. | 该溶液中一定含有A13+、CO32-、Cl- | |
| C. | 该溶液中可能含有Cl- | |
| D. | 该溶液中一定含有K+、AlO2-、CO32-、Cl- |
18.下列关于如图所示转化关系(X代表卤素)的说法错误的是( )
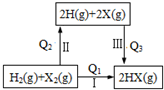

| A. | Q3>0 | B. | Q1=Q2+Q3 | ||
| C. | 按Cl、Br、I的顺序,Q2依次增大 | D. | Q1越大,HX越稳定 |
12.将一定量的氯气通入30mol,浓度为10.00mol/L的氢氧化钠溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A. | 若反应中转移的电子为n mol,则0.15<n<0.25 | |
| B. | n(Na+):n(Cl-) 可能为7:3 | |
| C. | 与NaOH反应的氯气一定为0.15 mol | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
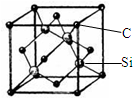 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:


