题目内容
19.按要求写出化学用语(1)赤铁矿主要成分的化学式Fe2O3
(2)孔雀石主要成分的化学式Cu2(OH)2CO3
(3)工业制氯气的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑
(4)镁在二氧化碳中燃烧的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
(5)铜与氯化铁溶液反应的离子方程式Cu+2Fe3+═2Fe2++Cu2+
(6)碳酸氢钠溶液和氢氧化钠溶液混合反应的离子方程式HCO3-+OH-=CO32-+H2O.
分析 (1)赤铁矿的主要成分是氧化铁;
(2)孔雀石的主要成分是碱式碳酸铜;
(3)工业上用电解饱和食盐水的方法制取氯气;
(4)镁在二氧化碳中燃烧生成氧化镁和C;
(5)铜和氯化铁发生氧化还原反应生成氯化亚铁和氯化铜;
(6)碳酸氢钠和氢氧化钠反应的实质是碳酸氢根和氢氧根反应.
解答 解:(1)赤铁矿的主要成分是氧化铁,化学式为Fe2O3,故答案为:Fe2O3;
(2)孔雀石的主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3,故答案为:Cu2(OH)2CO3;
(3)电解饱和食盐水生成氢氧化钠和氯气和氢气,离子方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(4)镁在二氧化碳中燃烧生成氧化镁和C,化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(5)氯化铁和Cu反应生成氯化亚铁和氯化铜,离子反应为Cu+2Fe3+═2Fe2++Cu2+,故答案为:Cu+2Fe3+═2Fe2++Cu2+;
(6)碳酸氢钠溶液和氢氧化钠溶液反应生成碳酸钠和水,离子方程式:HCO3-+OH-=CO32-+H2O;故答案为:HCO3-+OH-=CO32-+H2O;
点评 本题考查化学方程式、离子方程式的书写,掌握物质性质、反应原理和书写方法是解答的关键,题目较简单.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
4.欲除去CuSO4•5H2O中的沙子,必要的实验操作为( )
| A. | 溶解 过滤 蒸发结晶 | B. | 加热 溶解 过滤 | ||
| C. | 溶解 过滤 蒸馏 | D. | 溶解 过滤 分液 |
8. 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.
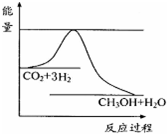
Ⅰ.减少二氧化碳的排放是一项重要客题.研究表明,CO2经催化加氢可合成低碳醇.
CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H
几种化学键的键能知表所示
(1)通过计算得出△H=-28kJ/mol.
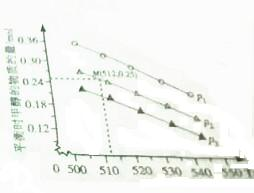
(2)在1.0L恒密闭容器中投入1molCO2和2.75molH2发生该反应,实验测得不同温度压强下,平衡时甲醇的物质的量如图所示.当压强为P2,温度为512K时,向该容器中投入1molCO2、0.5molH2、2molCH2OH、0.6molH2O,平衡向逆方向移动.
(3)以CH3OH、空气(O2含量20%)、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O,用该电池电解500mL1mol/LCuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.Ⅰ.减少二氧化碳的排放是一项重要客题.研究表明,CO2经催化加氢可合成低碳醇.
CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H
几种化学键的键能知表所示
| 化学键 | C=O | H-H | C-C | C-H | O-H | C-O |
| 键能/kJ、mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
(2)在1.0L恒密闭容器中投入1molCO2和2.75molH2发生该反应,实验测得不同温度压强下,平衡时甲醇的物质的量如图所示.当压强为P2,温度为512K时,向该容器中投入1molCO2、0.5molH2、2molCH2OH、0.6molH2O,平衡向逆方向移动.
(3)以CH3OH、空气(O2含量20%)、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O,用该电池电解500mL1mol/LCuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.

 ;
;

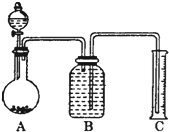
 依据事实,写出下列反应的热化学方程式
依据事实,写出下列反应的热化学方程式 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷; ;
; ;
;