题目内容
19.铝热反应可用于焊接钢轨,其反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,该反应为( )| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
分析 置换反应是指由一种单质和一种化合物反应,生成另外一种单质和一种化合物的反应.
解答 解:由化学方程式可知,反应物和生成物都是一种单质和一种化合物,属于置换反应.
故选A.
点评 本题主要考查反应类型方面的知识,难度不大,解答时要分析反应物和生成物的种类,然后再根据各种反应类型的概念方面进行分析、判断,从而得出正确的结论.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.设NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 常温常压下,32gO2和O3的混合气体所含质子数一定为16NA | |
| B. | 标准状况下,11.2LSO2中含有的分子数为0.5NA | |
| C. | 常温下,5.6 g铁与硝酸反应,失去的电子数一定为0.3 NA | |
| D. | 39g钾与足量氧气充分反应,转移的电子数一定是NA |
10.今有A、B、C三种元素,A、C元素原子的最外层电子数分别为6、2,B元素原子最外层电子数是内层电子数的2倍,A原子比B原子多一个电子层,C原子比B原子少一个电子层,这三种元素分别是( )
| A. | S、Si、Be | B. | O、C、Mg | C. | O、Si、Ca | D. | S、C、He |
7.某溶液含有K+,Fe3+、SO42-、CO32-、I-中的一种或几种.取样,滴加KSCN溶液后显红色,为确定该溶液组成,还需检验的离子是( )
| A. | K+ | B. | I- | C. | SO42- | D. | CO32- |
14.下列有关元素周期律的叙述中,正确的是( )
| A. | 非金属性强弱:F2<Cl2 | B. | 金属性强弱:K<Na | ||
| C. | 酸性强弱:H2SO4<HClO4 | D. | 碱性强弱:NaOH<Mg(OH)2 |
4.用容量瓶准确配制一定浓度的NaCl溶液时,下列操作会使溶液浓度偏高的是( )
| A. | 用粗盐代替NaCl固体 | |
| B. | 定容时,溶液液面低于容量瓶刻度线 | |
| C. | 从烧杯向容量瓶转移溶液时,有少量溶液溅出 | |
| D. | 向容量瓶转移溶液时,容量瓶中有少量蒸馏水 |
11.现有8种元素的性质、数据如下表所列,它们属于第二或第三周期.
回答下列问题:
(1)③的元素符号是Li,⑧的元素名称是硼.
(2)在最高价氧化物的水化物中,酸性最强的化合物的名称是高氯酸.
碱性最强的化合物的电子式是: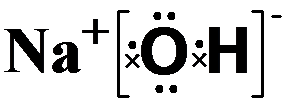 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用分子式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)③的元素符号是Li,⑧的元素名称是硼.
(2)在最高价氧化物的水化物中,酸性最强的化合物的名称是高氯酸.
碱性最强的化合物的电子式是:
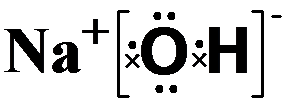 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).(3)比较④和⑦的氢化物的稳定性(用分子式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
8.A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都 有10个电子,其结构特点如下表:
其中,B的离子半径大于E的离子半径;D是由极性键构成的4原子分子;C常用作F的检验(加热).请填写下列空白:
(1)F粒子的电子式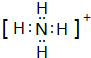 .
.
(2)比较BC和EC2的碱性强弱BC>EC2(填<、>、=).
(3)F与C加热时反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)F粒子的电子式
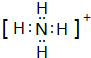 .
.(2)比较BC和EC2的碱性强弱BC>EC2(填<、>、=).
(3)F与C加热时反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.