题目内容
下列说法正确的是( )
| A、若两种粒子的核外电子排布完全相同,则化学性质一定相同 |
| B、如果两原子的核外电子排布相同,则一定属于同一种元素 |
| C、含有最高价元素的化合物一定具有强氧化性 |
| D、阳离子只能得电子被还原,做氧化剂 |
考点:原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:A.若两种粒子的核外电子排布完全相同,这两种元素可能不是同一种元素,其化学性质不一定相同;
B.如果两原子的核外电子排布相同,则这两种原子核内质子数相等;
C.含有最高价元素的化合物不一定具有强氧化性;
D.阳离子可能失电子作还原剂.
B.如果两原子的核外电子排布相同,则这两种原子核内质子数相等;
C.含有最高价元素的化合物不一定具有强氧化性;
D.阳离子可能失电子作还原剂.
解答:
解:A.若两种粒子的核外电子排布完全相同,如果是两种原子,则其质子数一定相等,为同位素,则其化学性质相同,如果是两种离子,其质子数不同,为两种元素,其化学性质一定不同,故A错误;
B.如果两原子的核外电子排布相同,则这两种原子核内质子数相等,为同一种元素,二者互称同位素,故B正确;
C.含有最高价元素的化合物不一定具有强氧化性,如稀硫酸具有弱氧化性,故C错误;
D.阳离子可能失电子作还原剂,如Fe2+,故D错误;
故选B.
B.如果两原子的核外电子排布相同,则这两种原子核内质子数相等,为同一种元素,二者互称同位素,故B正确;
C.含有最高价元素的化合物不一定具有强氧化性,如稀硫酸具有弱氧化性,故C错误;
D.阳离子可能失电子作还原剂,如Fe2+,故D错误;
故选B.
点评:本题考查了原子结构,涉及微粒的判断、氧化性和还原性的判断等知识点,根据微粒中质子数是否相同确定其化学性质是否相同,再结合微粒的氧化性、还原性来分析解答,易错选项是C,注意:含有最高价元素的化合物不一定具有强氧化性,溶液的浓稀也影响其氧化性,为易错点.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
“绿色化学”提倡化工生产应尽可能将反应物的原子全部利用,从根本上解决环境污染问题.在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是( )
A、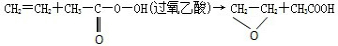 |
| B、CH2=CH2+Cl2+Ca(OH)2→CH2-CH2+CaCl2+H2O |
C、 |
D、 |
碘化钠与浓硫酸反应,反应方程式如下所示:8NaI+9H2SO4→8NaHSO4+4I2+H2S+4H2O;上述反应中哪种离子被氧化( )
| A、H+ |
| B、I- |
| C、Na+ |
| D、SO42- |
C6H14的各种同分异构体中,整个分子所含甲基数和它的一氯取代物的数目下列相符的是( )
| A、2个甲基,可能生成4种一氯代物 |
| B、3个甲基,可能生成5种一氯代物 |
| C、3个甲基,可能生成3种一氯代物 |
| D、4个甲基,可能生成4种一氯代物 |
设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A、醋酸的摩尔质量与NA个醋酸分子的质量(以克为单位)在数值上相等 |
| B、NA个氧气分子和NA个氢气分子的质量比等于16:1 |
| C、2.4g金属镁变成镁离子时失去的电子数目为0.1NA |
| D、17gNH3所含的原子数目为4NA,所含电子数目为10NA |
在日常生活中一次性使用聚乙烯用品会带来“白色污染”.这种材料难分解、难处理.聚乙烯的结构简式为  下列关于聚乙烯的说法错误的是( )
下列关于聚乙烯的说法错误的是( )
 下列关于聚乙烯的说法错误的是( )
下列关于聚乙烯的说法错误的是( )| A、由乙烯生成聚乙烯的反应属于加聚反应 |
| B、聚乙烯的单体为乙烯 |
| C、聚乙烯是一种纯净物 |
| D、聚乙烯结构简式中的n称为聚合度 |
下列有机物,其一氯代物的结构可能只有一种的是( )
| A、C3H8 |
| B、C8H8 |
| C、C4H10 |
| D、C5H12 |