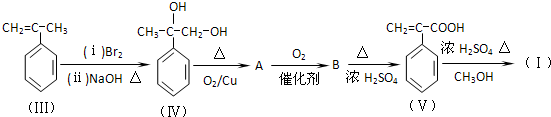
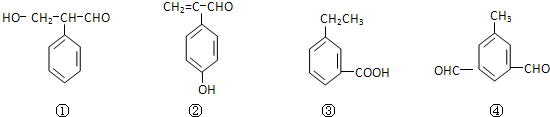
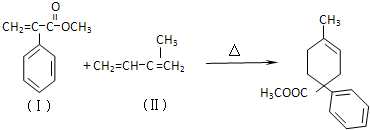题目内容
 某温度下,向一洁净干燥的烧杯中加入56gFe粉,然后加入400mL16mol?L-1浓HNO3,反应过程中产生气体的体积和反应时间的关系如图所示,最后固体全部溶解,气体体积均在标准状况下测定.假设反应中HNO3的还原产物只有NO和NO2,那么理论上开始产生NO的时刻为( )
某温度下,向一洁净干燥的烧杯中加入56gFe粉,然后加入400mL16mol?L-1浓HNO3,反应过程中产生气体的体积和反应时间的关系如图所示,最后固体全部溶解,气体体积均在标准状况下测定.假设反应中HNO3的还原产物只有NO和NO2,那么理论上开始产生NO的时刻为( )| A、t1 |
| B、t2 |
| C、t3 |
| D、t4 |
考点:氧化还原反应的计算,化学方程式的有关计算
专题:计算题
分析:n(Fe)=
=1mol,n(HNO3)=0.4L×16mol/L=6.4mol,假设反应中HNO3的还原产物只有NO和NO2,根据金属和硝酸反应时需要最多硝酸的物质的量,结合题给硝酸的物质的量确定金属是否完全反应,再结合转移电子守恒计算NO和NO2的体积,以此来解答.
| 56g |
| 56g/mol |
解答:
解:n(Fe)=
=1mol,n(HNO3)=0.4L×16mol/L=6.4mol,
由3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3(浓)=Fe(NO3)3+NO2↑+2H2O,
Fe与硝酸反应,完全转化生成二氧化氮时消耗酸最多,实际上n(HNO3)=6.4mol>4mol,所以硝酸有剩余,则Fe转化为Fe3+,
由图可知生成气体共44.8L,
混合气体为
=2mol,
设NO和NO2的物质的量分别为x、y,则
,
解得y=1.5mol,
其体积=22.4L/mol×1.5mol=33.6L,则从33.6L开始生成NO,
故选C.
| 56g |
| 56g/mol |
由3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3(浓)=Fe(NO3)3+NO2↑+2H2O,
Fe与硝酸反应,完全转化生成二氧化氮时消耗酸最多,实际上n(HNO3)=6.4mol>4mol,所以硝酸有剩余,则Fe转化为Fe3+,
由图可知生成气体共44.8L,
混合气体为
| 44.8L |
| 22.4L/mol |
设NO和NO2的物质的量分别为x、y,则
|
解得y=1.5mol,
其体积=22.4L/mol×1.5mol=33.6L,则从33.6L开始生成NO,
故选C.
点评:本题考查氧化还原反应的计算,为高频考点,把握发生的反应、硝酸过量的判断及守恒法应用为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关说法不正确的是 ( )
| A、反应NH3(g)+HCl(g)=NH4Cl(s)低温下能自发进行,说明该反应的△H<0 |
| B、常温下,将醋酸稀溶液加水稀释,溶液中c(H+)/c(CH3COOH)增大 |
| C、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| D、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
将4.34gNa、Na2O、Na2O2的混合物与足量水反应,生成的气体在标准状况下得到0.672L混合气体.该混合气体通过电火花产生器,恰好完全反应,则混合物中Na、Na2O和Na2O2的物质的量之比为( )
| A、1:1:1 |
| B、1:1:2 |
| C、1:2:1 |
| D、4:3:2 |
 在有机物分子中,当碳原子连有4个不同的原子或原子团时,这种碳原子称为“手性碳原子”,凡具有一个手性碳原子的化合物一定具有光学活性.例如下图表示的有机物中含有一个手性碳原子,具有光学活性.当发生下列变化时,生成的有机物无光学活性的是( )
在有机物分子中,当碳原子连有4个不同的原子或原子团时,这种碳原子称为“手性碳原子”,凡具有一个手性碳原子的化合物一定具有光学活性.例如下图表示的有机物中含有一个手性碳原子,具有光学活性.当发生下列变化时,生成的有机物无光学活性的是( )| A、与新制的银铵溶液共热 |
| B、与甲酸酯化 |
| C、与金属钠发生置换反应 |
| D、与H2加成 |
在治疗贫血的药物中,含有的主要成分是( )
| A、Na2CO3 |
| B、KCl |
| C、KIO3 |
| D、FeSO4 |