题目内容
已知H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
A.H2的燃烧热为241.8 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
C.1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ
D.断开1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量
【答案】
A
【解析】
试题分析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,题中水的状态是气态,不是稳定状态,水的稳定状态应该是液态,A不正确;B正确,由于气态水的能量高于液态水的能量,所以1mol H2完全燃烧生成液态水放出的热量大于241.8 kJ,C正确;反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以D正确,答案选A。
考点:考查燃烧热、反应热的有关判断和计算
点评:该题是中等难度的试题,也是高考中的常见考点之一。试题注重基础和能力的双向考查,有助于培养学生的逻辑推理能力。该题的关键是明确燃烧热以及反应热的概念,然后结合题意灵活运用即可。

练习册系列答案
 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
|
已知H2(g)+ CO(g)+ 某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为 | |
| [ ] | |
A. |
2∶1 |
B. |
1∶2 |
C. |
1∶1 |
D. |
2∶3 |
已知H2(g)+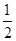 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
| A.H2的燃烧热为241.8 kJ·mol-1 |
| B.2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1 |
| C.1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ |
| D.断开1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量 |
