题目内容
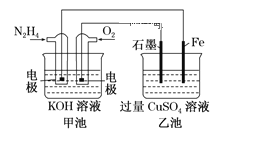
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母)。
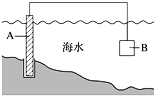
a.碳棒 b.锌板 c.铜板 d.钠块
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
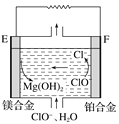
①E为该燃料电池的________(填“正”或“负”)极。F电极上的电极反应式为__________
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_________。
③0.4molCuSO4和0.4molNaCl溶于水,配成1L溶液,用该镁燃料电池用惰性电极进行电解,当一个电极得到0.3molCu时,另一个电极上生成的气体在标准状况下的体积为_______L。
(3)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
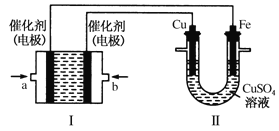
①b处应通入______(填“CH4”或“O2”),a处电极上发生的电极反应式是_________________;
②电镀结束后,装置Ⅰ中溶液的pH_____________;(填写“变大”“变小”或“不变”)装置Ⅱ中Cu2+的物质的量浓度_______________;(填写“变大”“变小”或“不变”)
③在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置Ⅰ中理论上消耗甲烷________L(标况)。
【答案】b 负 ClO-+2e-+H2O=Cl-+2OH- Mg+2H2O=Mg(OH)2+H2↑ 5.6 O2 CH4-8e-+10OH-=CO32-+7H2O 变小 不变 1.12
【解析】
(1)形成原电池时,Fe作正极被保护;活泼性比Fe强的金属作负极,被腐蚀。
(2)①原电池中,负极上失电子发生氧化反应,化合价升高,正极上得电子发生还原反应,化合价降低,据此判断正负极。
②镁能和热水反应生成氢氧化镁和氢气。
③电解硫酸铜和氯化钠溶液时,阳极上氯离子先放电,然后氢氧根离子放电,阴极上铜离子放电,后氢离子放电,当阴极上析出析出铜的物质的量为0.3mol<0.4mol,根据转移电子守恒计算阳极上生成气体体积。
(3)II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以b处通入的气体是O2。
①装置Ⅱ实现铁棒上镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,甲烷失电子和氢氧根离子反应生成碳酸根离子和水。
②装置Ⅰ中消耗氢氧化钾溶液PH减小,电镀过程中阳极上溶解的铜质量等于阴极上析出铜的质量。
③根据整个装置中电子转移相等计算消耗的甲烷的体积。
(1)该装置形成原电池,Fe作负极被保护,所以应该连接比Fe活泼的金属,故锌板。
故答案为:b;
(2)①电池中,负极上失电子发生氧化反应,化合价升高,正极上得电子发生还原反应,化合价降低,根据图知,Mg元素化合价由0价变为+2价、Cl元素化合价由+1价变为1价,所以E是负极、F是正极,正极上次氯酸根离子得电子和水反应生成氯离子和氢氧根离子,离子方程式为![]() 。
。
故答案为:负;![]() 。
。
②镁能和热水反应生成氢氧化镁和氢气而导致负极利用率降低,反应方程式为![]() 。
。
故答案为:![]() 。
。
③电解硫酸铜和氯化钠溶液时,阳极上氯离子先放电,然后氢氧根离子放电,阴极上铜离子放电,后氢离子放电,当阴极上析出铜的物质的量为0.3mol,阴极上转移电子的物质的量![]() ,根据原子守恒知,溶液中
,根据原子守恒知,溶液中![]() ,氯离子完全放电时转移电子的物质的量
,氯离子完全放电时转移电子的物质的量![]() ,所以阳极上生成的气体是氯气和氧气,生成氯气的体积为0.2mol即4.48L。根据电极反应,
,所以阳极上生成的气体是氯气和氧气,生成氯气的体积为0.2mol即4.48L。根据电极反应,![]() ,转移0.2mol电子,生成氧气的物质的量是0.05mol,即1.12L,所以另一个电极上生成的气体在标准状况下的体积是
,转移0.2mol电子,生成氧气的物质的量是0.05mol,即1.12L,所以另一个电极上生成的气体在标准状况下的体积是![]() 。
。
故答案为:5.6。
(3)①通过装置Ⅱ实现铁棒上镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以b处通入的气体是O2 ,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为![]() ,
,
故答案为: O2;![]() 。
。
②根据I中电池反应为![]() ,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量,则溶液中铜离子浓度不变。
,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量,则溶液中铜离子浓度不变。
故答案为:变小;不变。
③左边原电池和右边电解池转移电子数相等,所以消耗甲烷的体积 。
。
故答案为:1.12。

【题目】(1)500℃时,在2L密闭容器内发生2SO2(g)+O2(g)![]() 2SO3(g)的反应,其中n(SO2)随时间的变化如下表:
2SO3(g)的反应,其中n(SO2)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①在第5s时,SO2的转化率为__________________。
②能说明该反应已达到平衡状态的是_________________。
a. v(SO2)=v(O2) b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(2)硅是信息技术的关键材料。
化学键 | H-H | Si-Cl | Si-Si | H-Cl |
E/kJ·mol-1 | 436.0 | 360 | 176 | 431.8 |
用H2还原气态SiCl4制得28g硅的反应热为__________________。
(3)目前,消除氮氧化物污染有多种方法。
用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式_______。
【题目】在一定体积的密闭容器中,进行如下的化学反应CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度的关系如下表,根据信息推断以下说法正确的是
CO(g)+H2O(g),其化学平衡常数K和温度的关系如下表,根据信息推断以下说法正确的是
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
A.此反应为放热反应
B.此反应只有达到平衡时,密闭容器中的压强才不会变化
C.830℃时,反应物CO2与H2按1:1投料,平衡时H2的转化率为50%
D.该反应的化学平衡常数越大,反应物的转化率越低