题目内容
【题目】在一定体积的密闭容器中,进行如下的化学反应CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度的关系如下表,根据信息推断以下说法正确的是
CO(g)+H2O(g),其化学平衡常数K和温度的关系如下表,根据信息推断以下说法正确的是
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
A.此反应为放热反应
B.此反应只有达到平衡时,密闭容器中的压强才不会变化
C.830℃时,反应物CO2与H2按1:1投料,平衡时H2的转化率为50%
D.该反应的化学平衡常数越大,反应物的转化率越低
【答案】C
【解析】
A. 由表中数据可知,升高温度,K值增大,平衡正向移动,则此反应的正反应为吸热反应,A项错误;
B. 该反应前后为气体物质的量不变的反应,则容器中的压强始终不变,B项错误;
C. 830℃时,化学平衡常数等于1,则平衡时,c(CO2)c(H2)=c(CO)c(H2O),因反应物CO2与H2按1:1投料,假设CO2与H2初始各加入1mol/L,转化量为xmol/L,可得下列三段式:

由题意可得可得(1-x)(1-x)=x2,解得x=0.5,则平衡时H2的转化率为50%,C项正确;
D. 该反应的化学平衡常数越大,则正向进行的程度越大,反应物的转化率越大,D项错误;
答案选C。

 阅读快车系列答案
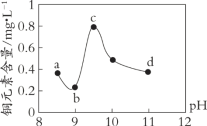
阅读快车系列答案【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。
查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升
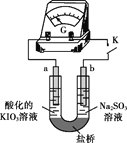
【题目】某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
资料:IO3-在酸性溶液氧化I-,反应为IO3- + 5I- + 6H+ = 3I2 + 3H2O
(1)溶液变蓝,说明Na2SO3具有_________性。
(2)针对t秒前溶液未变蓝,小组做出如下假设:
i.t秒前未生成I2,是由于反应的活化能______(填“大”或“小”),反应速率慢导致的。
ii.t秒前生成了I2,但由于存在Na2SO3,_____(用离子方程式表示),I2被消耗。
(3)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入_______,蓝色迅速消失,后再次变蓝。
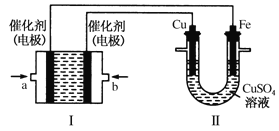
(4)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如下。
实验III:K闭合后,电流表的指针偏转情况记录如下表:
表盘 | |
| ||
时间/min | 0~t1 | t2~t3 | t4 | |
偏转 位置 | 右偏至Y | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针 归零 | |
① K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,现象是______。
② 0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断IO3- 在a极放电的产物是_______。
③ 结合反应解释t2~t3时指针回到“0”处的原因:________。
(5)综合实验I、II、III,下列说法正确的是_______。
A.对比实验I、II,t秒后溶液变蓝,I中SO32-被完全氧化
B.对比实验I、III,t秒前IO3- 未发生反应
C.实验III中指针返回X处的原因,可能是I2氧化SO32-