题目内容
【题目】下列关于有机物的说法不正确的是
A.苯和乙烯均可以使溴水褪色,但褪色原理不同
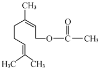
B.乳酸薄荷醇酯![]()
![]()
![]() 能发生水解、氧化、消去反应
能发生水解、氧化、消去反应
C.分子式为C4H11N的有机物,同分异构体有8种(不包括立体异构)
D.在制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明有乙酸剩余
【答案】D
【解析】
A.苯不含双键;
B.含-OH、-COOC-,结合醇、酯的性质分析;
C.该有机物为饱和链状结构,N可以为氨基,也可以为-NH-或![]() ;
;
D.乙酸与碳酸钠反应生成二氧化碳气体,浓硫酸也可与碳酸钠反应生成气体,乙酸乙酯不能。
A.苯和溴水不反应,可发生萃取作用,而乙烯可与溴发生加成反应,二者原理不同,A正确;
B.含-OH,可发生取代,由于羟基连接的C原子的邻位C原子上含有H原子,可发生消去反应,含-COOC-可发生水解反应,B正确;
C.C4H11N是饱和链状结构,无不饱和键,无环状结构所以两种情况①N在末端C4H9-NH2,(以下省略H)C-C-C-C-N(丁胺)、(2-甲丙胺)、(1-甲丙胺)、(1,1-二甲乙胺),总共有4种;②N在内部,包括-NH-类型的C-C-N-C-C(N-乙基-乙胺)、C-N-C-C-C(N-甲基-丙胺)、(N-甲基-1-甲基-乙胺)3种外,还存在![]() 这种情况(N上没有H),所以满足条件的有机物总共8种,C正确;
这种情况(N上没有H),所以满足条件的有机物总共8种,C正确;
D.乙酸乙酯制备中加入了浓硫酸,也可与碳酸钠反应生成气体,不能说明醋酸剩余,D错误;
故合理选项是D。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
元素 | H | Li | Be | B | C | N | O | F |
电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
元素 | Na | Mg | Al | Si | P | S | Cl | K |
电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
请仔细分析,回答下列有关问题:
(1)估计钙元素的电负性的取值范围:___________< X <___________;
(2)据表中的所给数据分析,同主族内的不同元素X的值变化的规律是_____________________________;
(3)某元素的电负性数值为1.8,请你预测其可能具有的性质(填“金属性、非金属性”等)__________________________________;
(4)据上表电负性数据,试推断AlBr3中形成的化学键的类型为______________,试用电子式表示其形成过程___________________________________________________________。
【题目】“低碳经济”备受关注,CO2的捕集、利用与封存成为科学家研究的重要课题。
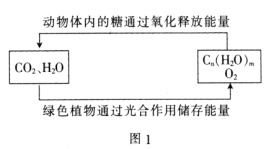
(1)绿色植物通过图1所示过程储存能量,用化学方程式表示其光合作用的过程:_______。
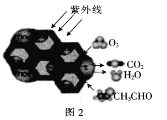
(2)TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物转化为CO2等小分子物质。图2为在TiO2的催化,O3降解CH3CHO的过程,则该反应的化学方程式为_____________________。
(3)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ/mol
CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJ/mol
O2(g)=CO2(g) △H2=-283 kJ/mol
CO(g)+H2O(g)=CO2(g)+2H2(g) △H3=-41 kJ/mol
则反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的 △H=___________________________。
2CO(g)+2H2(g)的 △H=___________________________。
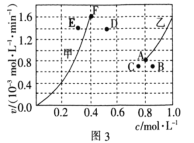
②为了探究反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol/L,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图3):v正-c(CH4)和v逆-c(CO),则与v正-c(CH4)相对应的是图中曲线________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol/L,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图3):v正-c(CH4)和v逆-c(CO),则与v正-c(CH4)相对应的是图中曲线________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3。
①在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容密闭容器中,分别在不同温度下进行反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得的有关数据见下表(t1<t2<t3)。
2NH3(g)+CO2(g)。实验测得的有关数据见下表(t1<t2<t3)。
| 15 | 25 | 35 |
0 | 0 | 0 | 0 |
t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
氨基甲酸铵分解反应是_______(填“放热”或“吸热”反应)。15℃时,此反应的化学平衡常数K=____________________。
②在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_____________________(已知常温下NH3·H2O的电离平衡常Kb=2×10-5,H2CO3的电离平衡常Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____________________(已知常温下NH3·H2O的电离平衡常Kb=2×10-5,H2CO3的电离平衡常Ka1=4×10-7)。