题目内容
一块11.0 g的铁铝合金,加入一定量的稀硫酸后完全溶解,然后加H2O2至溶液中无Fe2+存在,加热除去多余的H2O2,当加入200 mL 6 mol·L-1 NaOH溶液时沉淀量最多,且所得沉淀质量为26.3 g,下列说法不正确的是
A.该合金中铁的质量为5.6 g
B.该合金与稀硫酸反应共生成0.45 mol H2
C.该合金与足量氢氧化钠溶液反应,转移的电子数为0.6NA
D.所加的稀硫酸中含0.6 mol H2SO4
练习册系列答案
相关题目
3.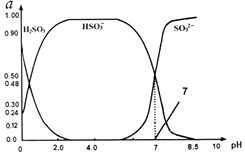 常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
 常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )| A. | 由图中数据可计算得到常温下亚硫酸溶液的Ka2 | |
| B. | 在0.1mol•L-1H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 向pH为7的溶液中滴入少量稀盐酸造成的溶液pH变化小于向pH为4.0的溶液中滴入相同量稀盐酸造成的溶液pH变化 | |
| D. | 在pH=2.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) |
4.如图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子是Ar
(2)地壳中含量最多的金属元素是Al;非金属性最强的元素F
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)在这些元素中,原子半径最小的是F,原子半径最大的是K.①的最高价氧化物对应的水化物的化学式为HNO3,其稀溶液与铜反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.当有0.4mol该物质被还原,则转移的电子为0.3mol.
(5)①、②、③所形成的气体氢化物的稳定性由强到弱的顺序HF>H2O>NH3
(6)完成下列反应的化学方程式:⑦的氧化物与氢氧化钠溶液反应SiO2+2NaOH=Na2SiO3+H2O,④、⑥的最高价氧化物对应的水化物两两反应:Al(OH)3+NaOH=NaAlO2+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 四 | ⑩ |
(2)地壳中含量最多的金属元素是Al;非金属性最强的元素F
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)在这些元素中,原子半径最小的是F,原子半径最大的是K.①的最高价氧化物对应的水化物的化学式为HNO3,其稀溶液与铜反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.当有0.4mol该物质被还原,则转移的电子为0.3mol.
(5)①、②、③所形成的气体氢化物的稳定性由强到弱的顺序HF>H2O>NH3
(6)完成下列反应的化学方程式:⑦的氧化物与氢氧化钠溶液反应SiO2+2NaOH=Na2SiO3+H2O,④、⑥的最高价氧化物对应的水化物两两反应:Al(OH)3+NaOH=NaAlO2+2H2O.
下列实验操作及现象与实验结论一致的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中不一定含有SO42- |
B | 光洁的铁钉放在冷的浓硫酸中,无明显现象 | 铁钉与冷的浓硫酸不反应 |
C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色 | 氧化性:Br2>Fe3+>I2 |
D | 向浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1的AgNO3溶液,产生的沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
下列实验操作能达到实验目的的是( )
选项 | 实验目的 | 实验操作 |
A | 除去CO2中少量的CO | 点燃 |
B | 除去CuSO4溶液中的少量FeSO4 | 加入足量的铜粉 |
C | 鉴别澄清石灰水和NaOH溶液 | 加入稀盐酸 |
D | 鉴别硬水和软水 | 加入肥皂水 |



