题目内容
3.下列指定反应的离子方程式正确的是( )| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 向Fe(OH)3胶体中加入氢碘酸溶液:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 将NaClO溶液与亚硫酸钠溶液混合:ClO-+SO32-═SO42-+Cl- | |
| D. | 用石墨作电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- |
分析 A.氨水为弱碱,一水合氨按不能拆开;
B.铁离子能够氧化碘离子;
C.次氯酸根离子能够将亚硫酸氢根离子氧化;
D.镁离子与氢氧根离子反应生成氢氧化镁沉淀.
解答 解:A.向Al2(SO4)3溶液中加入过量氨水,反应生成硫酸铵和氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.向Fe(OH)3胶体中加入氢碘酸溶液,二者发生氧化还原反应,正确的离子方程式为:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故B错误;
C.将NaClO溶液与亚硫酸钠溶液混合,反应生成硫酸钠氯化钠,反应的离子方程式为:ClO-+SO32-═SO42-+Cl-,故C正确;
D.反应生成氢气、氯气和氢氧化镁沉淀,正确的离子方程式为:Mg2++2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+Mg(OH)2,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
13.在蒸发皿中加热蒸干再加热下列物质的溶液,可以得到该物质固体的是( )
| A. | AlCl3 | B. | NaHCO3 | C. | Na2CO3 | D. | Al2(SO4)3 |
11.有机物甲、乙的结构如图所示,下列说法正确的是( )


| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能发生取代、加成反应 | |
| C. | 与甲具有相同官能团的同分异构体还有2种 | |
| D. | 与乙具有相同官能团的同分异构体还有2种 |
18.短周期主族元素甲、乙、丙、丁、戊的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,甲和丙同主族,丁原子最外层电子数与电子层数相等,在中学常见的酸中戊的最髙价氧化物对应的水化物的酸性最强.下列叙述错误的是( )
| A. | 氧元素与甲、乙、丙形成的二元化合物均只有两种 | |
| B. | 简单离子半径:戊>乙>丙>丁 | |
| C. | 甲、乙、戊三种元素可形成含有共价键的离子化合物 | |
| D. | 丙、丁、戊三种元素的最高价氧化物对应的水化物两两之间均能发生反应 |
8.4-AFMF是一种探测物质的荧光素,其结构简式如图.下列有关该物质的说法正确的是( )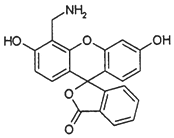

| A. | 分子中三个苯环处于同一平面 | |
| B. | 1 mol 4-AFMF 最多可与2molNaOH 反应 | |
| C. | 在酸性条件下水解,水解产物只有1种 | |
| D. | 能与溴水、FeCl3溶液及稀硫酸发生反应 |
1.为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4+H2?CHCl3+HCl△H=QKJ•mol-1.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据(不考虑副反应)
(1)110℃时平衡常数1
(2)实验1中,CCl4的转化率A为60%,平衡时c(CHCl3)=0.48mol/L
(3)实验2中,10小时后达到平衡,H2的平均反应速率为0.05mol/(L•h)
在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”);
(4)实验3中,B的值②
①等于50% ②大于50% ③小于50% ④无法判断
(5)能判断该反应已达到化学平衡状态的依据是BC
A.容器中压强不变
B.反应热△H不变
C.v正(H2)=v逆(HCl)
D.混合气体的密度保持不变.
| 实验序号 | 温度℃ | 初始CCl4浓度mol/L | 初始H2浓度mol/L | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 1 | B |
(2)实验1中,CCl4的转化率A为60%,平衡时c(CHCl3)=0.48mol/L
(3)实验2中,10小时后达到平衡,H2的平均反应速率为0.05mol/(L•h)
在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”);
(4)实验3中,B的值②
①等于50% ②大于50% ③小于50% ④无法判断
(5)能判断该反应已达到化学平衡状态的依据是BC
A.容器中压强不变
B.反应热△H不变
C.v正(H2)=v逆(HCl)
D.混合气体的密度保持不变.
18.下列离子方程式正确的是( )
| A. | 氯化铁溶液中加入足量的氨水:Fe3++3OH-═Fe(OH)3↓ | |
| B. | 铁片与稀硝酸反应Fe+2H+═Fe2++H2↑ | |
| C. | 氯气通入氯化亚铁溶液:Cl2+Fe2+═2Cl-+Fe3+ | |
| D. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O |
19. 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如表:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如表:
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是温度升高,合成氨平衡混合气体中NH3的体积分数减少,说明平衡逆向移动,而温度升高,平衡向吸热的方向移动,则合成氨反应是放热反应.
(2)根据如图,合成氨的热化学方程式是N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.
(3)取1mol N2(g)和3mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量小于92.2kJ(填“大于”“等于”或“小于”),原因是由于该反应是可逆反应,反应物无法全部转化为生成物;若加入催化剂,△H不变(填“变大”“变小”或“不变”).
(4)已知:分别破坏1mol N≡N键、1mol H-H键需要吸收的能量为:946kJ、436kJ,则破坏1mol N-H键需要吸收的能量为391kJ.
(5)N2H4可视为:NH3分子中的H被-NH2取代的产物.发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g).
已知:
N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534kJ•mol-1.
则:1mol N2H4与NO2完全反应的热化学方程式为N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85kJ•mol-1.
 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如表:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如表:| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是温度升高,合成氨平衡混合气体中NH3的体积分数减少,说明平衡逆向移动,而温度升高,平衡向吸热的方向移动,则合成氨反应是放热反应.
(2)根据如图,合成氨的热化学方程式是N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.
(3)取1mol N2(g)和3mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量小于92.2kJ(填“大于”“等于”或“小于”),原因是由于该反应是可逆反应,反应物无法全部转化为生成物;若加入催化剂,△H不变(填“变大”“变小”或“不变”).
(4)已知:分别破坏1mol N≡N键、1mol H-H键需要吸收的能量为:946kJ、436kJ,则破坏1mol N-H键需要吸收的能量为391kJ.
(5)N2H4可视为:NH3分子中的H被-NH2取代的产物.发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g).
已知:
N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534kJ•mol-1.
则:1mol N2H4与NO2完全反应的热化学方程式为N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85kJ•mol-1.
