题目内容
 (1)三聚氰胺分子的结构简式如图1所示,则其中氮原子轨道杂化类型是
(1)三聚氰胺分子的结构简式如图1所示,则其中氮原子轨道杂化类型是(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的M层电子排布式为
(3)过渡金属配合物Ni( CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
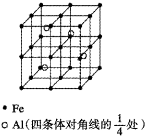
(4)碳化硅的晶胞结构(如图2)与金刚石类似(其中“●”为碳原子,“○”为硅原子).图中“●”点构成的堆积方式与下列图式中

(5)碳化硅的结构中,与碳原子距离最近且相等的碳原子有
考点:晶胞的计算,原子核外电子排布,共价键的形成及共价键的主要类型,配合物的成键情况,金属晶体的基本堆积模型,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)三聚氰胺分子中,氨基上的N原子成3个σ 键、有一个孤电子对,环上的N原子成2个σ 键、有一个孤电子对,杂化轨道数=σ 键数+孤电子对数,据此确定N原子杂化方式;根据三聚氰胺分子中含有σ 键计算;
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni;
(3)Ni的价电子数为10,每个配体提供一个电子对,根据10+2n=18计算;
(4)由图2可知,碳原子为面心立方堆积,为ABC型堆积;
(5)以顶点C原子研究,与之最近的C原子位于面心上,每个顶点原子为12个面共用;根据均摊法计算晶胞中C、Si原子数目,进而计算晶胞中含有C、Si原子总体积,计算晶胞的体积,晶胞的空间利用率=
×100%.
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni;
(3)Ni的价电子数为10,每个配体提供一个电子对,根据10+2n=18计算;
(4)由图2可知,碳原子为面心立方堆积,为ABC型堆积;
(5)以顶点C原子研究,与之最近的C原子位于面心上,每个顶点原子为12个面共用;根据均摊法计算晶胞中C、Si原子数目,进而计算晶胞中含有C、Si原子总体积,计算晶胞的体积,晶胞的空间利用率=
| 晶胞中C、Si原子总体积 |
| 晶胞体积 |
解答:
解:(1)三聚氰胺分子中,氨基上的N原子含有3个 σ 键和一个孤电子对,所以采取sp3杂化,环上的N原子含有2个 σ 键和一个孤电子对,所以采取sp2杂化,一个三聚氰胺分子中含有15个σ 键,所以1mol三聚氰胺分子中 σ 键为15mol,故答案为:sp2、sp3;15;
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的M层电子排布式为3s23p63d8,
故答案为:3s23p63d8;
(3)Ni的价电子数为10,每个配体提供一个电子对,则10+2n=18,故n=4,故答案为:4;
(4)由图2可知,碳原子为面心立方堆积,为ABC型堆积,选项D符合,故答案为:D;
(5)以顶点C原子研究,与之最近的C原子位于面心上,每个顶点原子为12个面共用,故与碳原子距离最近且相等的碳原子有12个;
算晶胞中C原子数目=8×
+6×
=4、Si原子数目=4,晶胞边长为a cm,则晶胞体积为a3cm3,碳原子直径为b cm,则晶胞中C原子总体积=4×
×π×(
)3cm3=
πb3cm3,硅原子直径为c cm,则晶胞中Si原子总体积=4×
×π×(
)3cm3=
πc3cm3,故晶胞中C、Si原子总体积=
πb3cm3+
πb3cm3=
π(b3+c3)cm3,故晶胞的空间利用率=
×100%=
×100%,
故答案为:
×100%.
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的M层电子排布式为3s23p63d8,
故答案为:3s23p63d8;
(3)Ni的价电子数为10,每个配体提供一个电子对,则10+2n=18,故n=4,故答案为:4;
(4)由图2可知,碳原子为面心立方堆积,为ABC型堆积,选项D符合,故答案为:D;
(5)以顶点C原子研究,与之最近的C原子位于面心上,每个顶点原子为12个面共用,故与碳原子距离最近且相等的碳原子有12个;
算晶胞中C原子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4 |
| 3 |
| b |
| 2 |
| 2 |
| 3 |
| 4 |
| 3 |
| c |
| 2 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| ||
| a3 cm3 |
| 2π(b3+c3) |
| 3a3 |
故答案为:
| 2π(b3+c3) |
| 3a3 |
点评:本题考查晶胞结构与计算、杂化理论、核外电子排布、化学键等,需要学生具有良好的空间想象力与计算能力,(4)(5)为易错点、难点.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列热化学方程式或离子方程式中,正确的是( )
A、在CH4、O2和KOH溶液组成的燃料电池中,负极反应式为:CH4-8e-+10OH-═CO
| ||
B、将SO2通入次氯酸钠溶液中:SO2+2ClO-+H2O═SO
| ||
| C、乙烯的燃烧热为a kJ/mol(a>0),则乙烯燃烧的热化学方程式可表示为:C2H4(g)+3O2(g)═2CO2(g)+2H2O(g),△H=-akJ/mol | ||
D、向苯酚钠(C6H5ONa)溶液中通入少量二氧化硫:C6H5O-+SO2+H2O→C6H5OH+HSO
|
下列各组离子在溶液中能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液( )
| A、Al3+、Na+、SO42-、NO3- |
| B、Ca2+、Mg2+、HCO3-、NO3- |
| C、Na+、Fe2+、AlO2-、Br- |
| D、K+、Na+、SiO32-、ClO- |
用NA代表阿伏加德罗常数,下列说法中正确的是( )
| A、1L 0.5mol/L FeCl3溶液中含Fe3+的数目为0.5NA |
| B、34g10%的双氧水中,含有的共价键数目为3NA |
| C、氯化钠晶体中一个钠离子周围距离最近的氯离子的数目为6个 |
| D、用含有0.1 mol FeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA |
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS).下列分析一定正确的是( )
| A、KSP(PbS)<Ksp(CuS) |
| B、原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C、CuSO4与ZnS反应的离子方程式是Cu2++s2-=CuS↓ |
| D、在自然界也发生着溶解度小的矿物转化为溶解度更小的矿物的现象 |
下列物质中,属于电解质的是( )
| A、铜 | B、乙醇 |
| C、稀硫酸 | D、氢氧化钾固体 |
 组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu、Fe等.
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu、Fe等.
 [化学一物质结构与性质]
[化学一物质结构与性质]