题目内容
1.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物水溶液呈碱性;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏.请回答下列问题:| … | E | A | B | ||
| C | … | D |
(2)由C、B、F三种元素构成的化合物中含有的化学键类型共价键和离子键
(3)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有①③(填序号).
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(4)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,可设计成的原电池,则其正极反应式为2Fe3++2e-=2Fe2+.
分析 A、B、C、D、E、F是中学化学中常见的六种短周期元素,A的气态氢化物水溶液呈碱性,则A为N元素;C单质一般保存在煤油中,则C为Na;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,则F为Al;G单质是日常生活中用量最大的金属,易被腐蚀或损坏,则G为Fe;由元素在周期表中的相对位置可知,E为C元素、B为O元素,D为Cl元素,结合元素化合物的性质和元素周期律解答.
解答 解:A、B、C、D、E、F是中学化学中常见的六种短周期元素,A的气态氢化物水溶液呈碱性,则A为N元素;C单质一般保存在煤油中,则C为Na;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,则F为Al;G单质是日常生活中用量最大的金属,易被腐蚀或损坏,则G为Fe;由元素在周期表中的相对位置可知,E为C元素、B为O元素,D为Cl元素,
(1)N的最高价氧化物对应的水化物与其氢化物反应生成离子化合物的化学式为 NH4NO3;
故答案为:NH4NO3;
(2)由Na、O、Al三种元素构成的化合物为NaAlO2,含有的化学键有共价键和离子键;
故答案为:共价键和离子键;
(3)A与B可组成质量比为7:16的三原子分子,N、O原子数目之比为$\frac{7}{14}$:$\frac{16}{16}$=1:2,该分子为NO2,可引起酸雨和光化学烟雾,
故答案为:①③;
(4)Cu与FeCl3溶液反应生成氯化铜和氯化亚铁,该反应设计为原电池,铜应为负极,石墨为正极,其反应中正极附近氯化铁失电子变为亚铁离子,正极电极方程式为:2Fe3++2e-=2Fe2+;
故答案为:2Fe3++2e-=2Fe2+.
点评 本题考查位置结构关系的相互应用,明确元素的推断是解答的关键,并利用化学键、周期表、电化学等知识点来解答即可,题目难度中等,侧重于考查学生的分析能力和应用能力.

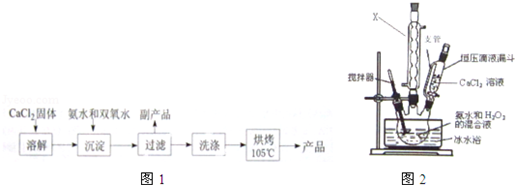
(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图1,反应装置如图2所示,请回答下列问题:
(1)X仪器名称球形冷凝管.
(2)加入氨水的作用是中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行.
(3)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少双氧水受热分解、降低产物溶解度便于析出(或该反应放热)(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B
A.热水B.冷水C.乙醇D.乙醚
(5)CaO2贮存时应该注意的问题是密封(或防潮、避免与易燃物接触等)(写一条即可)
(Ⅱ)CaO2纯度检测,将一定量CaO2溶于稀硫酸,用标准KMnO4溶于滴定生成的H2O2(KMnO4反应后生成Mn2+)计算确定CaO2的含量.
(6)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定所得数据如表所示,则CaO2样品的纯度90.00%
| 实验序号 | 第1次 | 第2次 | 第3次 | 第4次 |
| 消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
A.烘烤时间不足
B.在洁净干燥的酸式滴定管中未润洗即装标准液
C.滴定前尖嘴处有气泡.滴定后消失
D.配置KMnO4标准溶液定容时俯视容量瓶标线.
| A. | NO2 | B. | BF3 | C. | SO3 | D. | NF32+ |
| A. | 加成、酯化、缩聚 | B. | 加成、加成、加聚 | C. | 加成、消去、加聚 | D. | 加成、取代、缩聚 |
| A. | 若水槽中是水,试管中是CH4和Cl2,光照后可看到液面上升,有油状物产生 | |
| B. | 若水槽中是水(并滴有一定量酚酞),试管中是NH3可看到液面上升并呈红色 | |
| C. | 若水槽中是水,试管中是NO2,可看到试管中液面上升并充满整个试管 | |
| D. | 若水槽中和试管中都是氯水,光照后可在试管中收集到氧气 |
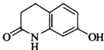 的水解产物互为同分异构体,能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种.写出两种满足上述条件的结构简式:
的水解产物互为同分异构体,能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2种.写出两种满足上述条件的结构简式: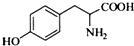 、
、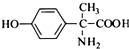 .
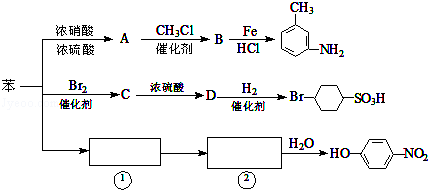
.
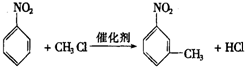 .
.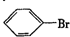 ,②
,②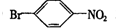 .
.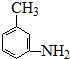 的所有原子不是(填“是”或“不是”)在同一平面上.
的所有原子不是(填“是”或“不是”)在同一平面上.