题目内容
9.科学家致力于CO2的“组合转化”技术研究,把过多的CO2转化为有益于人类的物质,如将CO2和H2以1:4的比例混合通入反应器中,在适当的条件下反应可获得一种重要的能源:CO2+4H2→CH4+2H2O.若将CO2与H2混合,在一定条件下以1:3的比例发生反应,生成某种重要的化工原料和水,该化工原料可能是( )| A. | 烷烃 | B. | 烯烃 | C. | 炔烃 | D. | 芳香烃 |
分析 结合选项所传递的关于化工原料由C、H元素组成的信息,可知1个CO2分子中的2个O原子应与4个H原子结合成2个水分子,即混合气体中的1个C原子应与2个H原子化合成化工原料,以此来解答.
解答 解:由反应物CO2和H2混合在一定条件下以1:3(分子数比)比例发生反应,可判断混合气体中C、H原子个数比为1:6;又由于反应后生成水,即有H原子与O原子化合成水分子;而在四个选项中的物质中都不含O元素,可判断1个CO2分子中的2个O原子应与4个H原子结合成2个水分子,即混合气体中的1个C原子应与2个H原子化合成化工原料,通过以上分析,可得出化工原料中C、H原子个数比应为1:2,选项中只有烯烃符合,
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握习题中的信息及有机物中C、H原子个数比为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
19.已知一定温度下的弱电解质的稀溶液,当加水稀释使物质的量浓度变为原来的$\frac{1}{m}$时,其电离程度将增大到原溶液电离度的$\sqrt{m}$倍,现有pH=1的某一元弱酸溶液10mL,加水至1L后,溶液的pH( )
| A. | 等于2 | B. | 在3~4之间 | C. | 等于3 | D. | 在2~3之间 |
20.下列实验操作中正确的是( )
①用剩的钠或钾应及时放回原试剂瓶
②蒸发硝酸钾溶液时要用玻璃棒不断搅动
③称取易潮解的药品必须放在玻璃器皿中称量
④用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体,观察试纸颜色变化
⑤将吸有氢氧化钠溶液的长胶头滴管伸入硫酸亚铁溶液中再挤出溶液以制得氢氧化亚铁
⑥水玻璃应该盛于磨口玻璃塞的试剂瓶中.
①用剩的钠或钾应及时放回原试剂瓶
②蒸发硝酸钾溶液时要用玻璃棒不断搅动
③称取易潮解的药品必须放在玻璃器皿中称量
④用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体,观察试纸颜色变化
⑤将吸有氢氧化钠溶液的长胶头滴管伸入硫酸亚铁溶液中再挤出溶液以制得氢氧化亚铁
⑥水玻璃应该盛于磨口玻璃塞的试剂瓶中.
| A. | ①③⑥ | B. | ②③④ | C. | ①②③⑤ | D. | ①②③④ |
4.苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理如图1和实验主要装置如图2:

已知:①甲苯为无色澄清液体,微溶于水,沸点110.6℃.
②苯甲酸的熔点为122.4℃.
③苯甲酸在25℃和95℃时的溶解度分别为0.17g和6.8g.
实验流程:
(Ⅰ)往三颈烧瓶中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,回流反应4小时.
(Ⅱ)将反应混合物趁热过滤,洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作B得白色较干燥粗产品.
(Ⅲ)纯度测定:称取1.22g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol•L-1KOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示:
请回答:
(1)仪器A的名称(球形)冷凝管;
(2)判断甲苯被氧化完全的实验现象是甲苯层消失,回流液不再有明显的油珠;
(3)洗涤时,下列洗涤剂最合适的是B
A、冷水 B、热水 C、乙醇 D、乙醇-水混合物
(4)根据实验流程(Ⅱ),回答下列两个问题:
①操作B的名称过滤;
②如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是将过量的KMnO4反应掉,防止其与浓盐酸反应;
(5)实验所得的苯甲酸在结晶过程中常裹携KCl析出,除去产品中KCl的实验方法的名称是重结晶;(已知KCl在水中的溶解度随温度的升高而迅速地增加)
(6)样品中苯甲酸纯度为96.00%.

已知:①甲苯为无色澄清液体,微溶于水,沸点110.6℃.
②苯甲酸的熔点为122.4℃.
③苯甲酸在25℃和95℃时的溶解度分别为0.17g和6.8g.
实验流程:
(Ⅰ)往三颈烧瓶中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,回流反应4小时.
(Ⅱ)将反应混合物趁热过滤,洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作B得白色较干燥粗产品.
(Ⅲ)纯度测定:称取1.22g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol•L-1KOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(1)仪器A的名称(球形)冷凝管;
(2)判断甲苯被氧化完全的实验现象是甲苯层消失,回流液不再有明显的油珠;
(3)洗涤时,下列洗涤剂最合适的是B
A、冷水 B、热水 C、乙醇 D、乙醇-水混合物
(4)根据实验流程(Ⅱ),回答下列两个问题:
①操作B的名称过滤;
②如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是将过量的KMnO4反应掉,防止其与浓盐酸反应;
(5)实验所得的苯甲酸在结晶过程中常裹携KCl析出,除去产品中KCl的实验方法的名称是重结晶;(已知KCl在水中的溶解度随温度的升高而迅速地增加)
(6)样品中苯甲酸纯度为96.00%.
14.实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
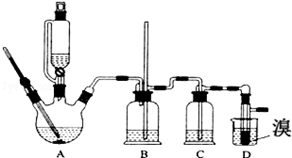
有关数据列表如下:
回答下列问题:
(1)写出装置A中的反应方程式为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;同时在装置C中应加入NaOH溶液.其目的是吸收反应中可能生成的酸性气体.
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);若产物中有少量未反应的Br2,可用NaOH溶液洗涤除去.
(4)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是如果用冰水冷却会使产品凝固而堵塞导管.

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)写出装置A中的反应方程式为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;同时在装置C中应加入NaOH溶液.其目的是吸收反应中可能生成的酸性气体.
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);若产物中有少量未反应的Br2,可用NaOH溶液洗涤除去.
(4)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是如果用冰水冷却会使产品凝固而堵塞导管.
18.NH4Cl溶液中,下列叙述正确的是( )
| A. | c(NH4+)>c(Cl-)>c(OH-)>c( H+) | B. | c(Cl-)>c(NH4+)>c( H+)>c(OH-) | ||
| C. | c(NH4+)+c( NH3)=c(Cl-)+c(OH-) | D. | c(NH4+)+c( NH3•H2O)+c( NH3)=c(Cl-) |