题目内容
A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当 A、B的物质的量之比为1:4且A为黑色固体时,该反应的离子方程式是 ;
②当 A、B的物质的量之比为1:6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移: .
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示) .
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1:2时,则A可能为 ,检查其中刺激性气体产物X的方法是 .
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1:4反应.
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为 .
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1:2时,则被还原的X是 mol.
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.若A和B按物质的量之比1:3反应则产生白色沉淀,则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 .
(5)若A、B、X、Y均为化合物.X为极易溶于水的气体,则盐A是 盐,X极易溶于水的原因是: .
(1)若Y为黄绿色气体:
①当 A、B的物质的量之比为1:4且A为黑色固体时,该反应的离子方程式是
②当 A、B的物质的量之比为1:6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示)
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1:2时,则A可能为
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1:4反应.
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1:2时,则被还原的X是
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.若A和B按物质的量之比1:3反应则产生白色沉淀,则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为
(5)若A、B、X、Y均为化合物.X为极易溶于水的气体,则盐A是
考点:无机物的推断
专题:推断题
分析:(1)若Y是黄绿色气体,则Y为氯气,
①但A、B的物质的量之比为1:4且A为黑色固体,该反应为二氧化锰与浓盐酸制备氯气;
②当 A、B的物质的量之比为1:6时,应是氯酸钾与盐酸反应生成氯化钾、氯气与水;
③氯气氧化亚硫酸钠生成酸、钠盐与水,同时发生酸与亚硫酸钠反应生成二氧化硫;
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1:2时,应是硫与浓硫酸反应生成二氧化硫与水,或铜与浓硫酸反应生成硫酸铜、二氧化硫与水;
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中,可知该反应为Fe与稀硝酸反应生成硝酸铁、NO与水;
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,A中含有Cl-;B的焰色为黄色,含有Na元素,若A和B按物质的量之比1:3反应产生白色沉淀,则A为氯化铝、B为氢氧化钠;
(5)若A、B、X、Y均为化合物.X为极易溶于水的气体,则盐A是铵盐,B为强碱,X为氨气,符合转化关系.
①但A、B的物质的量之比为1:4且A为黑色固体,该反应为二氧化锰与浓盐酸制备氯气;
②当 A、B的物质的量之比为1:6时,应是氯酸钾与盐酸反应生成氯化钾、氯气与水;
③氯气氧化亚硫酸钠生成酸、钠盐与水,同时发生酸与亚硫酸钠反应生成二氧化硫;
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1:2时,应是硫与浓硫酸反应生成二氧化硫与水,或铜与浓硫酸反应生成硫酸铜、二氧化硫与水;
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中,可知该反应为Fe与稀硝酸反应生成硝酸铁、NO与水;
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,A中含有Cl-;B的焰色为黄色,含有Na元素,若A和B按物质的量之比1:3反应产生白色沉淀,则A为氯化铝、B为氢氧化钠;
(5)若A、B、X、Y均为化合物.X为极易溶于水的气体,则盐A是铵盐,B为强碱,X为氨气,符合转化关系.
解答:
解:(1)若Y是黄绿色气体,则Y为氯气,
①但A、B的物质的量之比为1:4且A为黑色固体,该反应为二氧化锰与浓盐酸制备氯气,反应离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
②当 A、B的物质的量之比为1:6时,应是氯酸钾与盐酸反应生成氯化钾、氯气与水,用双线桥表示反应过程中的电子转移为: ,
,
故答案为: ;
;
③氯气氧化亚硫酸钠生成酸、钠盐与水,同时发生酸与亚硫酸钠反应生成二氧化硫,反应离子方程式为:4HSO3-+Cl2=SO42-+2Cl-+3SO2+2H2O,故答案为:4HSO3-+Cl2=SO42-+2Cl-+3SO2+2H2O;
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1:2时,应是硫与浓硫酸反应生成二氧化硫与水,或铜与浓硫酸反应生成硫酸铜、二氧化硫与水,刺激性气体产物X为二氧化硫,检验二氧化硫的方法为:将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2,
故答案为:C或Cu;将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2;
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中,可知该反应为Fe与稀硝酸反应生成硝酸铁、NO与水,
①100mL2mol/L的硝酸溶液中硝酸的物质的量=0.1L×2mol/L=0.2mol,由3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,可知生成硝酸亚铁的物质的量=0.2mol×
=0.075mol,故稀释至500mL后溶液中阴离子的物质的量浓度为
=0.3mol/L,
故答案为:0.3mol/L;
②设被还原的硝酸铁的物质的量是xmol,则:
2Fe3++Fe=3Fe2+
2 3
x mol 1.5x mol
所以(a-x):1.5x=1:2,解得x=
,
或(a-x):1.5x=2:1,解得x=0.25a
故答案为:0.25a或
;
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,A中含有Cl-;B的焰色为黄色,含有Na元素,若A和B按物质的量之比1:3反应产生白色沉淀,则A为氯化铝、B为氢氧化钠,
则A与B按物质的量之比1:4反应为:AlCl3+4NaOH=NaAlO2+3NaCl+H2O,反应后溶液中溶质的化学式为NaAlO2、NaCl,
故答案为:NaAlO2、NaCl;
(5)若A、B、X、Y均为化合物.X为极易溶于水的气体,则盐A是铵盐,B为强碱,X为氨气,符合转化关系,NH3和H2O间易形成分子间氢键,而极易溶于水,
故答案为:铵;NH3和H2O间易形成分子间氢键.
①但A、B的物质的量之比为1:4且A为黑色固体,该反应为二氧化锰与浓盐酸制备氯气,反应离子方程式为:MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
②当 A、B的物质的量之比为1:6时,应是氯酸钾与盐酸反应生成氯化钾、氯气与水,用双线桥表示反应过程中的电子转移为:
 ,
,故答案为:
 ;
;③氯气氧化亚硫酸钠生成酸、钠盐与水,同时发生酸与亚硫酸钠反应生成二氧化硫,反应离子方程式为:4HSO3-+Cl2=SO42-+2Cl-+3SO2+2H2O,故答案为:4HSO3-+Cl2=SO42-+2Cl-+3SO2+2H2O;
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1:2时,应是硫与浓硫酸反应生成二氧化硫与水,或铜与浓硫酸反应生成硫酸铜、二氧化硫与水,刺激性气体产物X为二氧化硫,检验二氧化硫的方法为:将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2,
故答案为:C或Cu;将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2;
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中,可知该反应为Fe与稀硝酸反应生成硝酸铁、NO与水,
①100mL2mol/L的硝酸溶液中硝酸的物质的量=0.1L×2mol/L=0.2mol,由3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,可知生成硝酸亚铁的物质的量=0.2mol×
| 3 |
| 8 |
| 0.075mol×2 |
| 0.5L |
故答案为:0.3mol/L;
②设被还原的硝酸铁的物质的量是xmol,则:
2Fe3++Fe=3Fe2+
2 3
x mol 1.5x mol
所以(a-x):1.5x=1:2,解得x=
| 4a |
| 7 |
或(a-x):1.5x=2:1,解得x=0.25a
故答案为:0.25a或
| 4a |
| 7 |
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,A中含有Cl-;B的焰色为黄色,含有Na元素,若A和B按物质的量之比1:3反应产生白色沉淀,则A为氯化铝、B为氢氧化钠,
则A与B按物质的量之比1:4反应为:AlCl3+4NaOH=NaAlO2+3NaCl+H2O,反应后溶液中溶质的化学式为NaAlO2、NaCl,
故答案为:NaAlO2、NaCl;
(5)若A、B、X、Y均为化合物.X为极易溶于水的气体,则盐A是铵盐,B为强碱,X为氨气,符合转化关系,NH3和H2O间易形成分子间氢键,而极易溶于水,
故答案为:铵;NH3和H2O间易形成分子间氢键.
点评:本题考查无机物推断,属于猜测验证型,需要学生熟练掌握元素化合物性质,难度中等.

练习册系列答案
相关题目
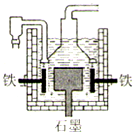 钠是一种重要的金属.工业上制钠的方法有下列三种.其反应原理分别为:
钠是一种重要的金属.工业上制钠的方法有下列三种.其反应原理分别为:Ⅰ:4NaOH(熔融)
| ||
Ⅱ:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑
Ⅲ:3NaCl(熔融)
| ||
下列有关说法正确的是( )
| A、制取等物质的量最的金属钠转移电子的物质的量关系是:Ⅰ=Ⅱ=Ⅲ |
| B、Ⅰ法制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑ |
| C、Ⅱ法制钠的原理是利用铁的还原性比钠强 |
| D、Ⅲ法制钠的电解槽装置如图,工作时电解槽的铁电极与电源的负极相连 |
向FeCl3稀溶液中滴加KSCN稀溶液,Fe3+和SCN-迅速反应生成Fe(SCN)3,并建立如下平衡:
Fe3+棕黄色+3SCN-无色?Fe(SCN)3红色
有关上述可逆反应的下列说法不正确的是( )
Fe3+棕黄色+3SCN-无色?Fe(SCN)3红色
有关上述可逆反应的下列说法不正确的是( )
| A、该反应的△H<0,△S<0 |
| B、向溶液中加少许KCl 固体或少许KOH固体平衡不移动 |
| C、对溶液所在体系加热,溶液红色变浅 |
| D、增大压强,反应混合物的颜色不变 |
下列化合物中指定化学键为非极性键的是( )
| A、CH3-CH3 |
| B、CH3-C6H4-OCH3 |
| C、H-CN |
| D、CH3-Cl |
 下面是关于药物华素片(西地碘片)使用说明中的部分内容:
下面是关于药物华素片(西地碘片)使用说明中的部分内容: