题目内容
5.常温下,在物质的量浓度之比为3:1的NaCl和H2SO4的混合溶液中,先滴入几滴紫色石蕊试液后,再用铂电极电解该混合溶液.根据电极产物和现象判断,该电解过程可明显分为三个阶段.下列叙述中,不正确的是( )| A. | 第一阶段中阴、阳两极产生的气体混合引燃后,恰好完全反应得到HCl | |
| B. | 阴极自始至终只产生H2 | |
| C. | 电解过程中,溶液的pH不断增大,最后等于7 | |
| D. | 电解过程中,Na+和SO42-的物质的量保持不变 |
分析 根据电解原理:阴极的放电离子:氢离子,阳极离子的放电顺序:氯离子>氢氧根离子,溶液中含有两种溶质NaCl和H2SO4,根据电解原理和离子物质的量,结合电子守恒计算判断放电的离子,来判断电解过程.
解答 解:可以将溶质看成3molNaCl和1molH2SO4,再转化一下思想,可以看成2molHCl,1molNa2SO4,1molNaCl,
由于1molNa2SO4自始至终无法放电,且其溶液pH=7,暂时可以忽略,电极反应为:
阳极:2Cl--2e-=Cl2↑ 2Cl--2e-=Cl2↑ 4OH--4e-=2H2O+O2↑
2 2 1 1
阴极:2H++2e-=H2↑ 2H++2e-=H2↑ 2H++2e-=H2↑
2 2 1 1
则电解过程可先看成电解HCl,再电解NaCl,最后电解水,
即2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑,2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,生成的NaOH为碱性,pH大于7;
A、第一阶段电解的是氯化氢,电解过程中阴、阳两极产生的气体氢气和氯气,依据电子守恒可知,混合引燃后,恰好完全反应得到HCl,故A正确;
B、阴极上始终是氢离子得到电子生成氢气,故B正确;
C、溶液pH不断增大,最后生成的NaOH为碱性,pH大于7,故C错误;
D、电解过程中,Na+和SO42-无法放电,物质的量不变,故D正确;
故选C.
点评 本题考查了电解质溶液的混合电解,溶液中离子放电顺序,电子守恒是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | C8H10含苯环的烃同分异构体有3种 | |
| B. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)是同系物 | |
| C. | 油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应 | |
| D. | 青蒿素是抗疟疾特效药,结构如图所示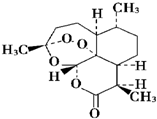 ,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取,能够发生水解反应,具有强氧化性 ,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,可以用乙醚从植物中提取,能够发生水解反应,具有强氧化性 |
①取少量样品加入足量水仍有部分固体未溶解:再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,震荡后仍有固体存在.
该白色粉末可能为( )
| A. | NaHCO3、Al(OH)3 | B. | AgCl、NaHCO3 | C. | Na2SO3、BaCO3 | D. | Na2CO3、CuSO4 |
| A. | 简单离子半径:W<X<Z | |
| B. | W与X形成的化合物溶于水后溶液呈碱性 | |
| C. | 气态氢化物的热稳定性:W<Y | |
| D. | 最高价氧化物的水化物的酸性:Y>Z |
| A. | 徐光宪建立稀土串级萃取理论 | B. | 屠呦呦发现抗疟新药青蒿素 | ||
| C. | 闵恩泽研发重油裂解催化剂 | D. | 侯德榜联合制碱法 |
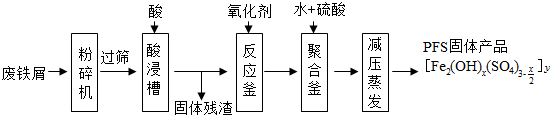
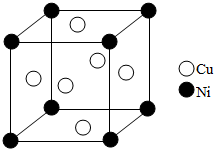 东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题: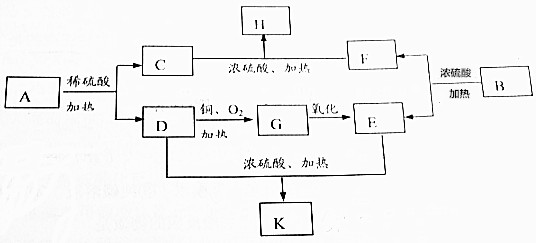
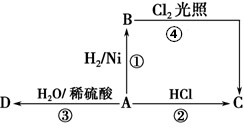
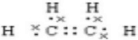 ;D的结构简式为CH3CH2OH.
;D的结构简式为CH3CH2OH.