题目内容
下列有关阿伏伽德罗常数说法正确的是( )
| A、含0.2mol H2SO4的浓硫酸与足量锌反应,生成气体的分子数小于0.1NA |
| B、标况下,22.4L四氯化碳所含分子数大于NA |
| C、0.1mol/L 的AgNO3溶液中,阳离子所带正电荷数目为0.1NA |
| D、标准状况下,11.2L HF含有的HF分子数为0.5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、浓硫酸和锌反应生成二氧化硫气体,随浓度变稀,和锌反应生成氢气,电子转移相同,生成气体的分子数大于0.1NA ;
B、四氯化碳标准状况不是气体;
C、溶液体积不知不能计算微粒数;
D、标准状况氟化氢不是气体.
B、四氯化碳标准状况不是气体;
C、溶液体积不知不能计算微粒数;
D、标准状况氟化氢不是气体.
解答:
解:A、浓硫酸和锌反应生成二氧化硫气体,随浓度变稀,和锌反应生成氢气,电子转移相同,Zn+2H2SO4=ZnSO4+SO2↑+2H2O,Zn+H2SO4=ZnSO4+H2↑,生成气体的分子数大于0.1NA ,故A错误;
B、四氯化碳标准状况是液体,22.4L四氯化碳物质的量大于1mol,22.4L四氯化碳所含分子数大于NA,故B正确;
C、溶液体积不知不能计算微粒数,故C错误;
D、标准状况氟化氢不是气体,11.2L HF物质的量不是0.5mol,故D错误;
故选B.
B、四氯化碳标准状况是液体,22.4L四氯化碳物质的量大于1mol,22.4L四氯化碳所含分子数大于NA,故B正确;
C、溶液体积不知不能计算微粒数,故C错误;
D、标准状况氟化氢不是气体,11.2L HF物质的量不是0.5mol,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的分析应用.主要是气体摩尔体积条件应用,掌握基础是关键,题目难度中等.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
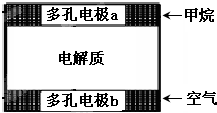 一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )
一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )| A、电极a反应式为:CH4+5O2--8e-=CO32-+2H2O |
| B、电极b是正极,O2-由电极a流向电极b |
| C、瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D、当固体电解质中有1mol O2-通过时,电子转移4mol |
下列说法中不正确的是( )
| A、常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 |
| B、在甲、乙两烧杯的溶液中,共含有Cu2+、K+、H+、Cl-、CO32-、OH-六种离子.已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的3种离子是K+、OH-、CO32- |
| C、在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-浓度变化最小 |
| D、常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+不能大量共存 |
两支试管中分别加入足量的等物质的量浓度的稀硫酸和氢氧化钠溶液,然后分别加入等质量的金属铝,充分反应,放出气体的体积比为( )
| A、2:3 | B、3:2 |
| C、1:3 | D、1:1 |
下列说法中,正确的是( )
| A、含有阴离子的化合物一定含有阳离子,含有阳离子的化合物不一定含有阴离子 |
| B、只含化学键而无分子间作用力的化合物晶体一定是原子晶体 |
| C、质子数和电子数均相同的两种微粒不可能是一种分子和一种离子 |
| D、只有分子中所有原子均达到2个或8个电子稳定结构的分子才是稳定分子 |
在一固定容积的密闭容器中,可逆反应N2+3H2?2NH3达到平衡的标志是( )
| A、v(N2)正=v(NH3)逆 |
| B、单位时间内3molH-H键断裂,同时6mol N-H键断裂 |
| C、n(N2):n(H2):(NH3)=1:3:2 |
| D、反应混合物各组分的物质的量浓度还在改变 |
化学创造了生活,也在改变着我们的生活.下列与化学有关的说法正确的是( )
| A、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,在空气中能产生丁达尔现象 |
| B、在海轮外壳上镶嵌锌块,会减缓船体的锈蚀 |
| C、经过必要的化学变化能从海水中提取NaCl、Mg、Br2等物质 |
| D、大量燃烧化石燃料排放的废气中大量CO2、SO2,造成大气污染,从而使雨水的PH=5.6形成酸雨 |
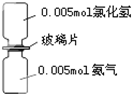 如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )| A、气体反应物的总体积为0.224L |
| B、产物中所含的N-H键个数为0.02NA |
| C、生成物中含有0.005NA个分子 |
| D、加1L水溶解后所得溶液中阳离子浓度为0.005mol?L-1 |