题目内容
有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1 )元素名称:A B C D
(2)写出AB2与过量氢氧化钠反应的离子方程式
(3)画出D的原子结构示意图 ,用电子式表示化合物 C2D 的形成过程 .
(1 )元素名称:A
(2)写出AB2与过量氢氧化钠反应的离子方程式
(3)画出D的原子结构示意图
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,所以A是C元素;C燃烧时呈现黄色火焰,C的单质在加热条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,所以C是Na元素,B是O元素,D是S元素,据此解答各小题即可.
解答:
解:有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,所以A是C元素;C燃烧时呈现黄色火焰,C的单质在加热条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,所以C是Na元素,B是O元素,D是S元素.
(1)通过以上分析知,A是C,B是O,C是Na,D是S,故答案为:碳;氧;钠;硫;
(2)AB2为CO2,CO2与过量的氢氧化钠反应生成碳酸钠和水,反应的离子方程式为:CO2+2OH-=CO32-+H20,故答案为:CO2+2OH-=CO32-+H20;
(3)D原子为S,其原子结构示意图为 ,C2D为Na2S,硫化钠为离子化合物,用电子式表示Na2S的形成过程为
,C2D为Na2S,硫化钠为离子化合物,用电子式表示Na2S的形成过程为 ,故答案为:
,故答案为: ;
; .
.
(1)通过以上分析知,A是C,B是O,C是Na,D是S,故答案为:碳;氧;钠;硫;
(2)AB2为CO2,CO2与过量的氢氧化钠反应生成碳酸钠和水,反应的离子方程式为:CO2+2OH-=CO32-+H20,故答案为:CO2+2OH-=CO32-+H20;
(3)D原子为S,其原子结构示意图为
 ,C2D为Na2S,硫化钠为离子化合物,用电子式表示Na2S的形成过程为
,C2D为Na2S,硫化钠为离子化合物,用电子式表示Na2S的形成过程为 ,故答案为:
,故答案为: ;
; .
.
点评:本题考查了原子结构示意图、用电子式表示离子化合物的形成过程,题目难度中等,注意掌握能够用电子式表示共价化合物和离子化合物的形成过程.

练习册系列答案
相关题目
下列有关实验操作中,正确的是( )
| A、用试管取出试剂瓶中的NaOH溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B、银镜反应实验后的废液可先倒入水槽中,再用水冲入下水道 |
| C、向试管中滴加液体时,胶头滴管必须紧贴试管内壁,避免液体溅出 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-=ZnO+H2O,Ag2O+2e-+H2O=2Ag+2OH-.椐此判断下列叙述中正确的是( )
| A、电池放电时,电池负极区溶液的碱性增强 |
| B、电池放电时,电子从Ag2O电极经外电路流向Zn电极 |
| C、Zn电极为负极,被氧化;Ag2O电极为正极,被还原 |
| D、Zn电极发生还原反应,Ag2O电极发生氧化反应 |
质子核磁共振谱(PMR)是研究有机物分子结构的有效方法之一,每一结构中的等性氢原子在PMR谱都给出了相应的峰(信号),峰的强度与结构中的H原子数成正比.那么,甲酸乙酯在PMR谱中的信号和强度分别应该是( )
| A、两个信号,强度之比为1:1 |
| B、三个信号,强度之比为1:1:1 |
| C、两个信号,强度之比为3:1 |
| D、三个信号,强度之比为3:2:1 |
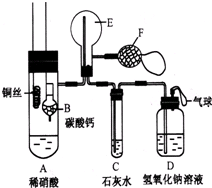 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
 如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答:
如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答: