题目内容
7.对于离子反应,下列说法正确的是( )| A. | 参加离子反应的一定都是电解质 | |
| B. | 任何一种离子的浓度在离子反应中一定变小 | |
| C. | 自由离子之间的反应不能在固态中进行 | |
| D. | 没有沉淀、气体、水生成的反应就不是离子反应 |
分析 A.金属与酸的反应为离子反应,但金属不是电解质;
B.生成物离子浓度增加;
C.固体中不存在自由移动的离子;
D.可发生氧化还原反应.
解答 解:A.活泼金属与酸的反应为离子反应,但金属不是电解质,故A错误;
B.生成物离子浓度增加,如氧化铜与酸的反应,铜离子浓度增大,故B错误;
C.固体中不存在自由移动的离子,故C正确;
D.可发生氧化还原反应,如高锰酸钾和氯气和二氧化硫的反应,故D错误.
故选C.
点评 本题考查离子反应的特点,为高频考点,侧重于学生的分析能力的考查,注意把握相关物质的性质以及相关概念的理解,难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
2. 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,写出该反应的离子方程式2I-+MnO2+4H+=Mn2++I2+2H2O.
(2)一种碘和氧的化合物(I4O9),可以称为碘酸碘,则I4O9中碘元素的化合价是CD.
A.-1 B.+1 C.+3 D.+5
(3)若IOH是两性化合物,写出IOH的酸式电离的电离方程式IOH?H++IO-.
(4)已知反应2HI(g)═H2(g)+I2(g)△H=+11kJ•mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.
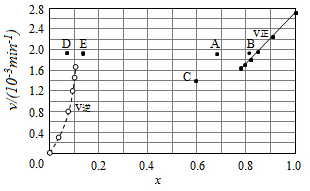
(5)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g).在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
①根据上述实验结果,该反应的平衡常数K的计算式为:$\frac{0.108×0.108}{0.78{4}^{2}}$.
②上述反应中,正反应速率为υ正=k正•x2(HI),逆反应速率为υ逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和k正表示).
③由上述实验数据计算得到υ正~x(HI)和υ逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为AE(填字母).
 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,写出该反应的离子方程式2I-+MnO2+4H+=Mn2++I2+2H2O.
(2)一种碘和氧的化合物(I4O9),可以称为碘酸碘,则I4O9中碘元素的化合价是CD.
A.-1 B.+1 C.+3 D.+5
(3)若IOH是两性化合物,写出IOH的酸式电离的电离方程式IOH?H++IO-.
(4)已知反应2HI(g)═H2(g)+I2(g)△H=+11kJ•mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.
(5)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g).在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为υ正=k正•x2(HI),逆反应速率为υ逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和k正表示).
③由上述实验数据计算得到υ正~x(HI)和υ逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为AE(填字母).
12.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 将58.5 g NaCl溶解于1 L 水中 | |
| B. | 将22.4 L氨气溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1的浓盐酸与9 L水混合 | |
| D. | 将10 g NaOH溶解在水中配成250 mL溶液 |
16.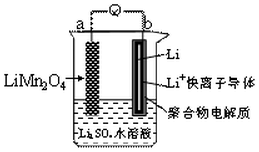 新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
 新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )| A. | a为电池的正极 | |
| B. | 电池充电反应为LiMn2O4═Li1-xMn2O4+xLi | |
| C. | 放电时,a极锂的化合价发生变化 | |
| D. | 放电时,溶液中Li+从b向a迁移 |