题目内容
10.A、B、C、D四种主族元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8.A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半.请回答下列问题:
(1)A元素在周期表中的位置为第三周期第VIA族
(2)A、D两种元素的原子半径由大到小的关系是r(Ca)>r(S)(分别填元素符号)
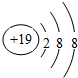
(3)试写出C元素的离子结构示意图:
(4)B元素的最高价氧化物对应水化物的化学式是HClO4,C、D元素最高价氧化物对应水化物的碱性的强弱KOH>Ca(OH)2(分别填化学式).
(5)能够生成气态氢化物的稳定性HCl>H2S,(分别填化学式)
(6)A、C两种元素最高价氧化物的水化物反应的离子方程式为H++OH-=H2O.
分析 A、B、C、D 四种元素的核电荷数依次增大,A原子的L层电子数与K、M层电子数之和相等,则M层电子数=8-2=6,故A为S元素;D原子的K、L层电子数之和等于电子总数的一半,则L层已经排满电子,故核外电子数=2×(2+8)=20,故D为Ca元素,四元素的离子的电子层数相同且最外层电子数均为8,结合原子序数,可推知,B为Cl、C为K,据此解答.
解答 解:A、B、C、D 四种元素的核电荷数依次增大,A原子的L层电子数与K、M层电子数之和相等,则M层电子数=8-2=6,故A为S元素;D原子的K、L层电子数之和等于电子总数的一半,则L层已经排满电子,故核外电子数=2×(2+8)=20,故D为Ca元素,四元素的离子的电子层数相同且最外层电子数均为8,结合原子序数,可推知,B为Cl、C为K.
(1)A为S元素,在周期表中的位置为第三周期第VIA族,故答案为:三、VIA;
(2)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Ca>S,故答案为:Ca;S;
(3)C元素的离子为K+,离子结构示意图: ,故答案为:
,故答案为: ;
;
(4)B元素的最高价氧化物对应水化物的化学式是:HClO4,金属性K>Ca,故最高价氧化物对应水化物的碱性:KOH>Ca(OH)2,故答案为:HClO4;KOH>Ca(OH)2;
(5)非金属性Cl>S,故气态氢化物的稳定性:HCl>H2S,故答案为:HCl>H2S;
(6)A、C两种元素最高价氧化物的水化物分别为硫酸、KOH,二者反应的离子方程式为:H++OH-=H2O,故答案为:H++OH-=H2O.
点评 本题考查结构性质位置关系应用,充分根据核外电子排布推断A、D,注意理解掌握元素周期律,难度不大.

练习册系列答案
相关题目
20.关于Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O的下列说法中,正确得是( )
| A. | 氧化剂与还原剂的物质的量之比是2:1 | |
| B. | 当生成22.4LSO2气体时,转移的电子数目是2NA | |
| C. | 该反应写成离子式是Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu+SO2↑+2H2O | |
| D. | 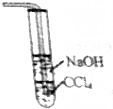 制备SO2装置尾气可用如图处理 |
1.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的最高价氧化物对应的水化物的化学式C、NaOH,D、Al(OH)3,E、HClO4;
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的氧化物对应水化物溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(4)A单质在E单质中燃烧的反应现象是安静的燃烧,苍白色火焰,产生白雾.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的最高价氧化物对应的水化物的化学式C、NaOH,D、Al(OH)3,E、HClO4;
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的氧化物对应水化物溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(4)A单质在E单质中燃烧的反应现象是安静的燃烧,苍白色火焰,产生白雾.
18.某化学小组以苯甲酸和异丙醇为原料,制取苯甲酸异丙酯(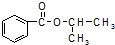 ),已知有关物质的沸点如表:
),已知有关物质的沸点如表:
合成苯甲酸异丙酯粗产品:
在如图圆底烧瓶中加入12.2g苯甲酸和30mL异丙醇(密度约为0.79g/cm3),再小心加入3mL浓硫酸,混匀后,加入几块碎瓷片,小心加热30分钟,使反应充分,得苯甲酸异丙酯粗产品.
(1)加入碎瓷片的目的是防止暴沸;
(2)异丙醇的系统命名法的名称为2-丙醇;
(3)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式 .
.
粗产品的精制:
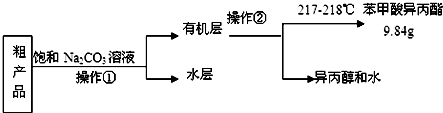
(4)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,现拟用下列流程图进行精制,操作①中用到的一种重要玻璃仪器是分液漏斗;操作②的名称是蒸馏.
(5)结合上述相关数据进行计算,苯甲酸异丙酯的产率为60%.
(6)该实验中不能用下列那个选项所对应的措施来提高苯甲酸甲酯的产率A.
A.苯甲酸的质量由12.2g增加至24.4g
B.30ml的异丙醇增加至35mL.
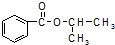 ),已知有关物质的沸点如表:
),已知有关物质的沸点如表:| 物质 | 异丙醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 82.4 | 249 | 218 |
在如图圆底烧瓶中加入12.2g苯甲酸和30mL异丙醇(密度约为0.79g/cm3),再小心加入3mL浓硫酸,混匀后,加入几块碎瓷片,小心加热30分钟,使反应充分,得苯甲酸异丙酯粗产品.
(1)加入碎瓷片的目的是防止暴沸;
(2)异丙醇的系统命名法的名称为2-丙醇;
(3)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式
 .
.粗产品的精制:
(4)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,现拟用下列流程图进行精制,操作①中用到的一种重要玻璃仪器是分液漏斗;操作②的名称是蒸馏.

(5)结合上述相关数据进行计算,苯甲酸异丙酯的产率为60%.
(6)该实验中不能用下列那个选项所对应的措施来提高苯甲酸甲酯的产率A.
A.苯甲酸的质量由12.2g增加至24.4g
B.30ml的异丙醇增加至35mL.
5.硒为第四周期VIA族元素,根据它在周期表中位置推测,硒不可能具有的性质( )
| A. | 单质有还原性 | B. | 硒元素在化合物中可显-2价 | ||
| C. | 硒化氢水溶液显弱碱性 | D. | 最高价氧化物的水化物显酸性 |
15.A、B、C、D、E均为有机化合物,A是分子式为C5H10O的直链化合物,B与NaHCO3溶液完全反应,其物质的量之比为1:2,它们之间的关系如图所示(提示:RCH=CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基).下列叙述错误的是( )
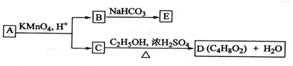

| A. | B的结构简式为HOOC-CH2-COOH | |
| B. | C与乙醇发生了酯化反应 | |
| C. | A的结构简式是CH3-CH(OH)-CH=CH-CH3 | |
| D. | E的分子式为C3H2O4Na2 |
2.下列化学用语表示正确的是( )
| A. | 甲烷的比例模型: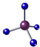 | B. | O2与O22-互为同分异构体 | ||
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同素异形体 | D. | S2-的结构示意图: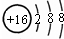 |
19.下列所述的两者是同种物质的是( )
| A. | HCl和盐酸 | B. | 干冰和CO2 | C. | 正丁烷和异丁烷 | D. | 白磷和红磷 |
20.下列各组化合物中,所含化学键类型完全相同的是( )
| A. | CaCl2和Na2O2 | B. | NaOH和CCl4 | C. | CO2和MgCl2 | D. | NaOH和NaClO |