题目内容
18.将镁条放入盛有CO2和O2混合气体的密闭容器中充分燃烧.(1)若Mg条的质量为6.6g,反应后容器内O2有剩余,则在反应后容器内的固体物质中一定含有MgO,该固体物质的量为0.275mol.
(2)若Mg粉质量ag,混合气体的体积为bL,反应后容器内有O2剩余,则在bL混合气体中,V(O2)的取值范围是$\frac{7}{15}$aL<V(O2)<bL.
(3)若Mg粉质量ag,混合气体的体积仍为bL,反应后容器内无气体剩余,则在bL混合气体中,则反应后容器内固体物质质量的最大值是(a+$\frac{44b}{22.4}$)g.(气体体积均已折算成标准状态下的数据)
分析 (1)当氧气有剩余时,镁只与氧气反应,所以生成产物为氧化镁,根据镁的质量及反应方程式计算出生成氧化镁的物质的量;
(2)混合气体中氧气有剩余,则镁完全反应,氧气的体积一定小于bL,据此可知氧气的最大体积;当镁恰好与氧气反应时,此时氧气的体积最小,根据n=$\frac{m}{M}$计算出ag镁的物质的量,再结合反应方程式计算出氧气的物质的量及体积;
(3)若容器中无气体剩余,说明镁足量,假设气体全部是氧气,且氧气完全反应时固体的质量最小;当气体全部是二氧化碳,根据2Mg+CO2→2MgO+C知,固体增加的质量为二氧化碳的质量,此时得到的固体质量最大,据此进行解答.
解答 解:(1)6.6g镁的物质的量=$\frac{6.6g}{24g/mol}$=0.275mol,若氧气有剩余,则镁只和氧气反应生成MgO,根据原子守恒生成MgO的物质的量为:n(MgO)=n(Mg)=0.275mol,
故答案为:MgO;0.275mol;
(2)氧气有剩余,氧气的最小体积大于和镁完全反应的体积,而小于气体总体积,根据反应2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO可知,镁和氧气恰好反应时需要气体氧气物质的量=$\frac{a}{24}$mol×$\frac{1}{2}$=$\frac{a}{48}$mol,则需要氧气体积为:22.4L/mol×$\frac{a}{48}$mol=$\frac{7}{15}$aL,
所以氧气的体积为:$\frac{7}{15}$aL<V(O2)<bL;
故答案为:$\frac{7}{15}$aL<V(O2)<bL;
(3)若容器中无气体剩余,说明镁足量,假设气体全部是氧气,氧气完全反应时固体质量增加的质量:$\frac{b}{22.4}$mol×32g/mol=$\frac{32b}{22.4}$g,则固体质量为(a+$\frac{32b}{22.4}$)g;
假设气体全部是二氧化碳,根据2Mg+CO2→2MgO+C知,固体增加的质量为二氧化碳的质量,所以固体增加的质量为:$\frac{b}{22.4}$mol×44g/mol=$\frac{44b}{22.4}$g,所以固体质量为(a+$\frac{44b}{22.4}$)g,
则容器内固体质量为(a+$\frac{32b}{22.4}$)g<m<(a+$\frac{44b}{22.4}$)g,
所以反应后固体的最大值为(a+$\frac{44b}{22.4}$)g,
故答案为:(a+$\frac{44b}{22.4}$)g.
点评 本题考查了有关范围讨论的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

 金钥匙试卷系列答案
金钥匙试卷系列答案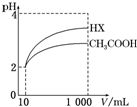 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)a.CH3COOH,b.H2CO3,c.HClO的酸性由强到弱的顺序为a>b>c(填编号).
(2)同浓度的a.CH3COO-,b.HCO${\;}_{3}^{-}$,c.CO${\;}_{3}^{2-}$,d.ClO-结合H+的能力由强到弱的顺序为c>d>b>a(填编号).
(3)向NaClO溶液中通入少量的CO2,反应的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
(4)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是c>d>b>a(填编号).
(5)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填序号).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D. c(H+)•c(CH3COO-)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是ABCD.
(6)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数大于(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
| 选项 | 反应叙述 | 产物图示 |
| A | NaOH溶液与SO2 反应时溶液中的溶质 |  |
| B | NaAlO2溶液与盐酸反 应后铝元素的存在形式 |  |
| C | Fe和稀HNO3反应 后,铁元素的存在形式 | 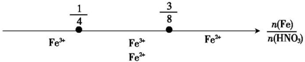 |
| D | Fe在Cl2中的燃烧产物 |  |
| A. | A | B. | B | C. | C | D. | D |
| A. | 不小心将少量浓硫酸沾到皮肤,立即用水冲洗 | |
| B. | 如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液 | |
| C. | 为了避免浪费,应该把实验用剩的药品放回原试剂瓶中 | |
| D. | 连接并组装成套仪器时,一般按自下而上、从左到右的顺序进行安装 |
| 化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7, K2=5.6×l0-11 |
| A. | CH3COO-、CO32-、CN-在溶液中可以大量共存 | |
| B. | 向食醋中加入水可使CH3COOH的电离平衡向电离方向移动 | |
| C. | 相同物质的量浓度的Na2CO3和NaCN溶液,前者pH较大 | |
| D. | pH=a的上述3种酸溶液,加水后溶液的pH相同,则醋酸中加入的水最多 |
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的.其主要反应是:①2C+O2→2CO ②C+H2O(g)→CO+H2 ③CO+H2O(g)→CO2+H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:则表中x=44m3.
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
N2(g)+O2(g)?2NO(g)△H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
(3)SO2和氮的氧化物都是空气中的有害气体,已知:
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
(4)25℃时,电离平衡常数:
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
a.常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系不正确的是AD
A.c(Na+)>c(ClO-)>c(HCO3-)>c(OH-)
B.c(Na+)>c(HCO3-)>c(ClO-)>c(H+)
C.c(Na+)═c(HClO)+c(ClO-)+c(HCO3-)+c(H2CO3)+c(CO32-)
D.c(Na+)+c(H+)═c(ClO-)+c(HCO3-)+2c(CO32-)
E.c(HClO)+c(H+)+c(H2CO3)═c(OH-)+c(CO32-)
b.常温下,0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2c(C4H4O62-)=(0.05+10-6-10-8)mol/L.(列出计算式)
| A. | 标准状况下,2.24 LCCl4中含Cl原子数目等于0.4NA | |
| B. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| C. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA | |
| D. | 1 mol甲基(-CH3)中含有电子的数目为10NA |