题目内容
8. 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)a.CH3COOH,b.H2CO3,c.HClO的酸性由强到弱的顺序为a>b>c(填编号).
(2)同浓度的a.CH3COO-,b.HCO${\;}_{3}^{-}$,c.CO${\;}_{3}^{2-}$,d.ClO-结合H+的能力由强到弱的顺序为c>d>b>a(填编号).
(3)向NaClO溶液中通入少量的CO2,反应的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
(4)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是c>d>b>a(填编号).
(5)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填序号).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D. c(H+)•c(CH3COO-)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是ABCD.
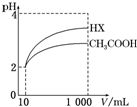
(6)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数大于(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
分析 (1)电离平衡常数越大,酸的电离程度越大,溶液酸性越强;
(2)酸根离子对应酸的酸的电离平衡常数越大,则其结合氢离子能力越弱;
(3)次氯酸的酸性大于碳酸氢根离子,二者反应生成碳酸氢钠和次氯酸;
(4)四种溶液水解都显示碱性,pH相同时,酸根离子对应的酸性越强,离子的浓度越大;
(5)CH3COOH溶液加水稀释过程中,醋酸的电离程度增大,氢离子浓度、醋酸根离子浓度减小,但氢氧根离子浓度增大;由于温度不变,则电离平衡常数、水的离子积不变;升高温度后醋酸的电离程度增大,则溶液中氢离子浓度增大、水的离子积增大、电离平衡常数增大;
(6)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小.
解答 解:(1)根据表中数据可知,酸的电离出平衡常数大小为:CH3COOH>H2CO3>HCO3->HClO,电离平衡常数越大,酸性越强,所以酸性由强到弱的顺序为为:CH3COOH>H2CO3>HClO,
故答案为:a>b>c;
(2)酸根离子对应酸的酸的电离平衡常数越大,则其结合氢离子能力越弱,由于电离平衡常数CH3COOH>H2CO3>HCO3->HClO,则同浓度CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为:CO32->ClO->HCO3->CH3COO-,
故答案为:c>d>b>a;
(3)NaClO溶液中通入少量CO2,反应生成碳酸氢钠和次氯酸,反应的离子方程式为:ClO-+CO2+H2O=HCO3-+HClO,
故答案为:ClO-+CO2+H2O=HCO3-+HClO;
(4)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,由于酸根离子部分水解,四种溶液都呈碱性,pH相同时,酸根离子对应的酸的酸性越强,其水解程度越弱,若使pH相同,则其盐溶液的浓度越大,由于酸性CH3COOH>H2CO3>HCO3->HClO,所以四种溶液的浓度大小为:c>d>b>a,
故答案为:c>d>b>a;
(5)A.0.1mol•L-1的CH3COOH溶液加稀释过程中,溶液中氢离子浓度减小,故A正确;
B.0.1mol•L-1的CH3COOH溶液加稀释过程中,各个微粒浓度减小,同时醋酸的电离向右移动,c(H+)减小的程度小于c(CH3COOH)的减小程度,则c(H+)/c(CH3COOH)增大,故B错误;
C.Kw=c(H+)•c(OH-)只受温度的影响,温度不变则其值是一个常数,故C错误;
D.c(H+)•c(CH3COO-)/c(CH3COOH)为醋酸的电离平衡常数,由于温度不变,则水的电离平衡常数不变,故D错误;
故答案为:A;
若该溶液升高温度,醋酸、水的电离程度对增大,则溶液中氢离子、氢氧根离子浓度都增大,
A.升高温度后溶液中氢离子浓度c(H+)增大,故A正确;
B.升高温度后氢离子、氢氧根离子浓度都增大,醋酸的浓度减小,则(H+)/c(CH3COOH)增大,故B正确;
C.c(H+)•c(OH-)为水的离子积,升高温度后水的电离程度增大,则水的离子积增大,故C正确;
D.c(H+)•c(CH3COO-)/c(CH3COOH)是醋酸的电离平衡常数,升高温度后产生的电离平衡常数增大,故D正确;
故答案为:ABCD;
(6)根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HX的pH变化比CH3COOH的大,故HX酸性强,电离平衡常数大;HX酸性强于CH3COOH的,稀释后HX溶液中c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱,
故答案为:大于;大于.
点评 本题考查了弱电解质的电离及其影响,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力,明确温度、浓度等对电离平衡常数、水的离子积的影响为解答关键.

 名校课堂系列答案
名校课堂系列答案| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | Na+0.3 | B. | Ba2+0.2 | C. | CO${\;}_{3}^{2-}$ 0.2 | D. | Zn2+0.2 |
| A. | Al | B. | Fe | C. | Cu | D. | Ag |
| A. | pH<7 | B. | pH=7 | C. | pH>7 | D. | 都有可能 |
①水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
②胶体区别于其他分散系的本质特征是分散质颗粒直径大小
③区分胶体和其他分散系的最简便方法是利用丁达尔效应
④往Fe(OH)3胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解
⑤医院里用血液透析的方法治疗肾功能衰竭等疾病引起的血液中毒
⑥FeCl3溶液和小苏打溶液混合会产生红褐色沉淀和无色气体
⑦同一支钢笔先后吸入不同牌子的墨水易造成钢笔堵塞
⑧胶体具有介稳性的主要原因是胶体粒子可以通过吸附而带有电荷,且同种胶体粒子的电性相同
⑨在Fe(OH)3胶体中,Fe(OH)3胶体粒子的数目要远远小于原FeCl3溶液中Fe3+的数目.
| A. | ①②③④⑦⑥⑧ | B. | ①②④⑤⑦⑧⑨ | C. | ①③④⑤⑦⑧ | D. | ①②③④⑤⑦⑧⑨ |
| A. | 当消耗0.1 mol Zn时,得到的还原产物为0.1 mol | |
| B. | 反应结束时,可得到0.25 mol ZnSO4 | |
| C. | 当溶液中不再产生气泡时,溶液中大量存在的阳离子只有Zn2+ | |
| D. | 最后生成的单质为Fe |