��Ŀ����
����Ŀ��Ī���εĻ�ѧʽΪ![]() ����Է�������Ϊ392����������ˮ���������Ҵ�����һ����Ҫ�Ļ�ԭ�����ڿ����б�һ����������ȶ���������ijѧϰС������Ʊ�����Ī���ε�ʵ��װ�ü����衣�ش�������⣺
����Է�������Ϊ392����������ˮ���������Ҵ�����һ����Ҫ�Ļ�ԭ�����ڿ����б�һ����������ȶ���������ijѧϰС������Ʊ�����Ī���ε�ʵ��װ�ü����衣�ش�������⣺
����һ����ȡĪ����
��1������װ�ã����װ�������Ժ����ҩƷ������ƿ�м���![]() ��м��������̼�ۣ���������ƿ�м���
��м��������̼�ۣ���������ƿ�м���![]() ���壮��������̼�۵�������_____��
���壮��������̼�۵�������_____��
��2�����Һ©����ע��![]() ϡ����رջ���
ϡ����رջ���![]() ����
����![]() ��
��![]() ����ϡ����ע����ƿ��ر�
����ϡ����ע����ƿ��ر�![]() ��
��![]() װ���з�Ӧ�����ӷ���ʽΪ______��
װ���з�Ӧ�����ӷ���ʽΪ______��
��3�����������ܽ��![]() ���ر�
���ر�![]() ����ʱ���Կ���������Ϊ_____��ԭ����_____��
����ʱ���Կ���������Ϊ_____��ԭ����_____��
��4���رջ���![]() ��
��![]() ������100��ˮԡ����
������100��ˮԡ����![]() ��ˮ�֣�Һ�������Ĥʱ��ֹͣ���ȣ���ȴ�ᾧ��____����������ƣ�������ˮ�Ҵ�ϴ�Ӿ��塣�÷�Ӧ�������������������Һ��
��ˮ�֣�Һ�������Ĥʱ��ֹͣ���ȣ���ȴ�ᾧ��____����������ƣ�������ˮ�Ҵ�ϴ�Ӿ��塣�÷�Ӧ�������������������Һ��![]() ��1~2֮�䣬��Ŀ��Ϊ_____��
��1~2֮�䣬��Ŀ��Ϊ_____��
��5��װ��![]() ������Ϊ______��
������Ϊ______��
��������ⶨĪ������Ʒ�Ĵ���
��6����ȡ����Ī������Ʒ![]() ������к���ȴ������ˮ���
������к���ȴ������ˮ���![]() ��Һ��ȡ
��Һ��ȡ![]() ��Һ����ϡ���ᣬ��
��Һ����ϡ���ᣬ��![]() ��
��![]() ��Һ�ζ����ﵽ�ζ��յ�ʱ����
��Һ�ζ����ﵽ�ζ��յ�ʱ����![]() ��Һ���ζ���Ӧ�����ӷ���ʽΪ________������Ʒ�Ĵ���Ϊ________��
��Һ���ζ���Ӧ�����ӷ���ʽΪ________������Ʒ�Ĵ���Ϊ________��
���𰸡�������ϡ���ṹ��ԭ��أ��ӿ췴Ӧ���� ![]()
![]() �е�Һ�屻ѹ��
�е�Һ�屻ѹ��![]() ��
�� ![]() �в���������ʹ
�в���������ʹ![]() ��ѹǿ���� ���� ����
��ѹǿ���� ���� ����![]() ˮ�� Һ�����ã���ֹ��������������ƿ����
ˮ�� Һ�����ã���ֹ��������������ƿ���� ![]() 98%
98%
��������
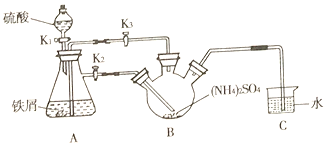
����һ����ȡĪ���Σ���Һ©���Ͽ����ӣ��رջ���K3����K2��K1������55.0mL2molL-1ϡ���ᣬ���������Ӧ������������װ���ڵĿ����ų������������ܽ��K3���ر�K2��A�е�Һ�屻ѹ��B�У��رջ���K2��K3������100��ˮԡ����B��ˮ�֣�������Ī���Σ���ȴ�ᾧ�����ˣ�����ˮ�Ҵ�ϴ�ӣ��ɵõ�Ī���ξ��壬װ��C������Һ�⣬��ֹ��������������ƿ����Fe2+��
��������ⶨĪ������Ʒ�Ĵ��ȣ�����5Fe2++MnO4-+8H+�T5Fe3++Mn2++4H2O��������ӷ���ʽ���㣻
(1) ����ƿ����![]() ��м��������̼�ۺ�ϡ���ᣬ�������ᷴӦ�����У�����̼��ϡ���ṹ����ԭ��أ��ӿ��˷�Ӧ���ʣ�
��м��������̼�ۺ�ϡ���ᣬ�������ᷴӦ�����У�����̼��ϡ���ṹ����ԭ��أ��ӿ��˷�Ӧ���ʣ�
��Ϊ��������ϡ���ṹ��ԭ��أ��ӿ췴Ӧ���ʣ�
(2)�������ᷴӦ������������������,���ӷ���ʽΪ![]() ��
��
����![]() ��
��
(3)���������ܽ��![]() ���ر�
���ر�![]() ����ʱ���Կ�����A�е�Һ�屻ѹ��B�У�ԭ���ǹر�
����ʱ���Կ�����A�е�Һ�屻ѹ��B�У�ԭ���ǹر�![]() �Ժ��������ڲ���ȴ��������ƿ�ڣ���A��ѹǿ�����Һ��ѹ��B�У�
�Ժ��������ڲ���ȴ��������ƿ�ڣ���A��ѹǿ�����Һ��ѹ��B�У�
��Ϊ��A�е�Һ�屻ѹ��B�У�A�в���������ʹA��ѹǿ����
(4) ���˿ɽ��������Һ�з������������������ǿ�������λ�ˮ�⣬���������������������ˮ�⣻
��Ϊ�����ˣ�����![]() ˮ�⣻
ˮ�⣻
(5)���ܲ���Һ�����¿���Һ�����ã���ֹ��������������ƿ����Fe2+��
��Ϊ��Һ�����ã���ֹ��������������ƿ������
(6)�������������Ը�����ط���![]() n(KMnO4)=0.01L��0.1mol/L=0.001mol����20.00mL��Һ��n(Fe2+)=0.005mol����10.0g��Ʒ��
n(KMnO4)=0.01L��0.1mol/L=0.001mol����20.00mL��Һ��n(Fe2+)=0.005mol����10.0g��Ʒ��![]() �����ʵ���Ϊ0.025mol����Ʒ�ĺ���Ϊ
�����ʵ���Ϊ0.025mol����Ʒ�ĺ���Ϊ![]() ��
��
�ʴ�Ϊ��![]() ��98%��
��98%��

����Ŀ��H2O2��Ϊ��ɫ��������Ӧ���ڷ�ˮ��������ֽ�ͻ�ѧ�ϳɵ���ҵ��
��1����֪��H2(g)+![]() O2(g)=H2O(l) ��H1=��285.8kJ��mol-1
O2(g)=H2O(l) ��H1=��285.8kJ��mol-1
H2(g)+O2(g)=H2O2(l) ��H2=��135.8kJ��mol-1
��H2(g)��O2(g)�ķ�Ӧ�У�������ѧ�ϸ������IJ�����__��ԭ����__��
�ڳ����£�H2O2�ֽ���Ȼ�ѧ����ʽΪ__��
��2���ҹ���ѧ��ʹ��Ag9�Ŵ����������о�H2O2�ĺϳɡ�������Ļ�ܺͷ�Ӧ�ȣ������ʾ�����ü����ģ�ⷴӦ������ͼ��ʾ��TS��ʾ����̬����ʾ���������������֣���
Ag9�Ŵ�������H2O2�Ļ��Ea�ͷ�Ӧ��![]()
���� | ����̬ | Ea/kJ |
| |
A | Ag9 | TS1 | 74.1 | +68.7 |
B | H��Ag9 | TS2 | 108.7 | -27.2 |
C | H��Ag9��H+ O2 | TS3 | 78.4 | -75.4 |
D | HOO | TS4 | 124.7 | +31.3 |

��ͨ�����Ͳ���___������ĸ�������ݣ���ܣ������Խϴ������ߺϳɷ�Ӧ�����ʡ�
�ڷ�Ӧ������2��3���ѵĻ�ѧ��Ϊ___������ţ���
A.O2������� B.H2������ C.Ag9OOH������
��3������������ͬ���ŵ����H2O2�������[(NH4)2S2O8]��ԭ����ͼ��ʾ�������Ϸŵ��������___�������ĵ缫��ӦʽΪ___��

��4�������£�H2O2�ֽ����ʷ���v=0.0625��c(H2O2)mg��L-1��s-1��c(H2O2)��ʱ��仯���±���
C(H2O2) (mg | 10000.0 | 8000.0 | 4000.0 | 2000.0 | 1000.0 |
�ֽ�ʱ��(s) | 0 | 7 | 23 | 39 | 55 |
�ٵ�c(H2O2)=8000.0mg��L-1ʱ��v=__mg��L-1��s-1��
�ڵ�c(H2O2)��Ϊ5000.0mg��L-1ʱ���ֽ�ʱ��Ϊ___s��