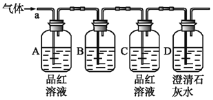
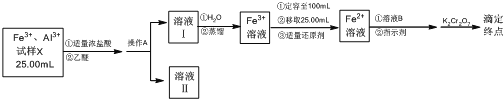
题目内容
【题目】某同学称取9.00g淀粉溶于水,测定淀粉的水解百分率.其程序如下:
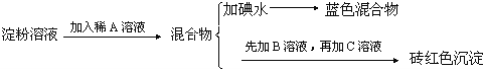
试回答下列问题:
(1)各步加入的试剂为:A_________,B_________,C_________;
(2)加入A溶液而不加入B溶液是否可以_________,其理由是_________;
(3)写出淀粉水解的方程式_________;
(4)当析出1.44g砖红色沉淀时,淀粉水解率是_________;[已知葡萄糖与Cu(OH)2反应的化学方程式为:CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
【答案】 H2SO4 NaOH Cu(OH)2悬浊液 不可以 葡萄糖与氢氧化铜的反应必须在碱性条件下才能进行 (C6H10O5)n+n H2O![]() n C6H12O6 18%
n C6H12O6 18%
【解析】分析:淀粉在酸性条件下水解生成葡萄糖,加碱中和之后溶液呈碱性,然后加入新制的氢氧化铜悬浊液,有砖红色沉淀生成,此法可检验淀粉水解的产物葡萄糖;淀粉遇碘单质变蓝;
葡萄糖与新制氢氧化铜反应应该在碱性环境下进行;
依据(C6H10O5)n~nC6H12O6~nCu2O,根据生成的Cu2O的质量求出水解的淀粉的质量,淀粉的水解率=![]() ×100%。
×100%。
(1)淀粉在稀硫酸作用下水解生成葡萄糖,加Na0H溶液中和稀硫酸,使混合液呈碱性;向混合液中加入新制氢氧化铜悬浊液,加热至沸腾生成红色沉淀,证明淀粉已水解,水解后的溶液加碘水变蓝,则说明水解不完全;因此,本题答案为:H2SO4 ;NaOH; Cu(OH)2悬浊液;
(2)葡萄糖与新制Cu(OH)2悬浊液反应应该在碱性环境下进行,加Na0H溶液的作用是中和稀硫酸,使混合液呈碱性,若不加氢氧化钠溶液,此时的酸性环境破坏了新制Cu(OH)2悬浊液,所以不可以不加入B溶液,因此,本题答案为:不可以;葡萄糖与氢氧化铜的反应必须在碱性条件下才能进行;
(3)淀粉水解的方程式为:(C6H10O5)n(淀粉)+nH2O![]() nC6H12O6(葡萄糖);
nC6H12O6(葡萄糖);
(4)一元醛与新制氢氧化铜反应的方程式为:
CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH)4COOH+2H2O+Cu2O↓,
CH2OH(CHOH)4COOH+2H2O+Cu2O↓,
设水解的淀粉的质量为x。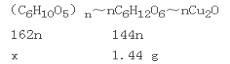
x=![]() =1.62g;
=1.62g;
淀粉的水解率=![]() ×100%=
×100%=![]() ×100%=18%。
×100%=18%。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1= -41.0 kJ/mol
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2= -49.0 kJ/mol
③CH3OCH3(g)+H2O(g) 2CH3OH(g) ΔH3= +23.5 kJ/mol
则反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO2与NO2反应生成SO3和NO,将混合气体经冷凝分离出的SO3可用于制备硫酸。
①973 K时,测得:NO2(g) NO(g)+ ![]() O2(g) K1=0.018;SO2(g) +
O2(g) K1=0.018;SO2(g) + ![]() O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充入SO2、NO2 各0.2mol。平衡时SO2的转化率为______。
③恒压下,SO2的分压PSO2随温度的变化如图所示:
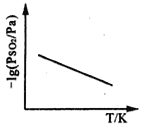
当温度升高时,SO2(g)+NO2(g) SO3(g)+NO(g)的化学平衡常数______(填“增大”或“减小”), 判断理由是______________________。
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是______________________。
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。下表中Ⅰ和Ⅱ产生差异的原因可能是________________________________________;Ⅱ中0~20min,用NO3-表示的平均反应速率为______________mol·L-l·min-1。
反应时间/min | 0 | 10 | 20 | 30 | 40 | |
Ⅰ | c(NO3-)/10-4 mol·L-1 | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
Ⅱ | c(NO3-)/10-4 mol·L-1 (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.c(Na+)+c(H+)=c(HSO3-) +2c(SO32-) +c(OH-)
B.c(Na+) =c(HSO3-) +c(SO32-) +c(H2SO3)
C.c(Na+) >c(SO32-) >c(HSO3-) > (OH-)c>c(H+)
D.c(H+) +c(SO32-) =c(OH-) +c(H2SO3)