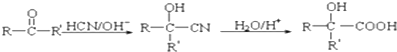题目内容
用离子方程式解释下列化学过程正确的是( )
| A、工业上用石灰乳制取漂白粉:2OH-+Cl2=Cl-+ClO-+H2O |
| B、碳酸氢钠溶液中滴加酚酞呈粉红色:HCO3-+H2O=H2CO3+OH- |
| C、水玻璃可用于制备硅胶:SiO32-+2H+=H2SiO3(胶体) |
| D、标况下2.24LCl2通入100mL 1mol/L FeBr2溶液中:2Fe2++Cl2=2Fe3++2Cl- |
考点:离子方程式的书写
专题:
分析:A.石灰乳微溶于水,作反应物写化学式;
B.碳酸氢根离子水解程度大于其电离程度,水解生成碳酸和氢氧根离子而使其溶液呈碱性,但水解程度较小,应该写可逆号;
C.水玻璃的成分是硅酸钠,硅酸酸性小于盐酸,盐酸和硅酸钠反应制备硅酸;
D.标况下,2.24LCl2的物质的量是0.1mol,100mL 1mol/L FeBr2溶液中FeBr2的物质的量是0.1mol,氯气先氧化亚铁离子后氧化溴离子,1mol亚铁离子被0.05mol氯气完全氧化,剩余0.05mol氯气氧化0.1mol溴离子.
B.碳酸氢根离子水解程度大于其电离程度,水解生成碳酸和氢氧根离子而使其溶液呈碱性,但水解程度较小,应该写可逆号;
C.水玻璃的成分是硅酸钠,硅酸酸性小于盐酸,盐酸和硅酸钠反应制备硅酸;
D.标况下,2.24LCl2的物质的量是0.1mol,100mL 1mol/L FeBr2溶液中FeBr2的物质的量是0.1mol,氯气先氧化亚铁离子后氧化溴离子,1mol亚铁离子被0.05mol氯气完全氧化,剩余0.05mol氯气氧化0.1mol溴离子.
解答:
解:A.石灰乳微溶于水,作反应物写化学式,离子方程式为Ca(OH)2+Cl2=Cl-+ClO-+H2O+Ca 2+,故A错误;
B.碳酸氢根离子水解程度大于其电离程度,水解生成碳酸和氢氧根离子而使其溶液呈碱性,但水解程度较小,应该写可逆号,离子方程式为HCO3-+H2O?H2CO3+OH-,故B错误;
C.水玻璃的成分是硅酸钠,硅酸酸性小于盐酸,盐酸和硅酸钠反应制备硅酸,离子方程式为SiO32-+2H+=H2SiO3(胶体),故C正确;
D.标况下,2.24LCl2的物质的量是0.1mol,100mL 1mol/L FeBr2溶液中FeBr2的物质的量是0.1mol,氯气先氧化亚铁离子后氧化溴离子,1mol亚铁离子被0.05mol氯气完全氧化,剩余0.05mol氯气氧化0.1mol溴离子,离子方程式为2Fe2++2Cl2+2Br-=2Fe3++4Cl-+Br2,故D错误;
故选C.
B.碳酸氢根离子水解程度大于其电离程度,水解生成碳酸和氢氧根离子而使其溶液呈碱性,但水解程度较小,应该写可逆号,离子方程式为HCO3-+H2O?H2CO3+OH-,故B错误;
C.水玻璃的成分是硅酸钠,硅酸酸性小于盐酸,盐酸和硅酸钠反应制备硅酸,离子方程式为SiO32-+2H+=H2SiO3(胶体),故C正确;
D.标况下,2.24LCl2的物质的量是0.1mol,100mL 1mol/L FeBr2溶液中FeBr2的物质的量是0.1mol,氯气先氧化亚铁离子后氧化溴离子,1mol亚铁离子被0.05mol氯气完全氧化,剩余0.05mol氯气氧化0.1mol溴离子,离子方程式为2Fe2++2Cl2+2Br-=2Fe3++4Cl-+Br2,故D错误;
故选C.
点评:本题考查离子方程式正误判断,明确离子性质及离子方程式书写规则即可解答,注意有些反应与反应物的量、浓度有关,易错选项是D,注意离子反应先后顺序及反应物的量,为易错点.

练习册系列答案
相关题目
2001年9月1日将执行国家食品卫生标准规定,酱油中3-氯丙醇(ClCH2CH2CH2OH)含量不得超过10-4%.相对分子质量为94.5的氯丙醇(已知-OH基和-Cl不能连在同一个碳原子上)共有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
下列说法正确的是( )
| A、需要加热方能发生的反应一定是吸热反应 |
| B、放热的反应在常温下一定很易发生 |
| C、一个反应是放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定,而不是由反应是否需要加热而决定 |
| D、吸热反应发生过程中要不断从外界获得能量、放热反应发生过程中不再需要外界能量 |
将2.3g钠投入水中,要保证每100个水分子中溶有1个钠离子,加入的水的质量是( )
| A、180g |
| B、200.8g |
| C、230g |
| D、181.8g |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、100mL 1mol/L FeCl3溶液中含阳离子数为0.1NA |
| B、常温常压下1 mol NO2气体与水反应生成NA个NO3-离子 |
| C、0.6 g CaCO3与Mg3N2的混合物中所含质子数为0.3NA |
| D、80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA |
下列说法正确的是( )
①只由一种元素组成的物质,一定是纯净物;
②离子化合物中一定含离子键,可能含共价键,一定含金属元素;
③硝酸和盐酸既有氧化性,又有还原性;
④碱性氧化物一定是金属氧化物.
①只由一种元素组成的物质,一定是纯净物;
②离子化合物中一定含离子键,可能含共价键,一定含金属元素;
③硝酸和盐酸既有氧化性,又有还原性;
④碱性氧化物一定是金属氧化物.
| A、①② | B、①④ | C、②③ | D、③④ |
依据下列实验,不能证明一元酸HR是弱酸的是( )
| A、室温下NaR溶液的pH大于7 |
| B、加热NaR溶液时,溶液的pH变小 |
| C、稀盐酸中加入少量NaR固体,溶解后溶液的pH变大 |
| D、HR溶液中加少量NaR固体,溶解后溶液的pH变大 |