题目内容
13.已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.实验室制备溴乙烷(沸点为38.4℃)的装置如图1:圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,小火加热,使NaBr充分反应.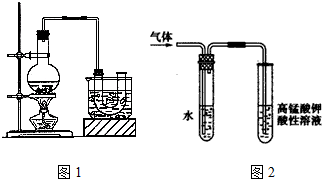
(1)反应时若温度过高会降低溴乙烷的产率,原因是溴乙烷的沸点低易挥发;也可看到有红棕色气体产生,该气体的化学式为Br2.为避免温度过高,宜采用水浴加热.
(2)反应结束后,U形管中粗制的溴乙烷呈棕黄色.为了除去其中的杂质,最好选用下列试剂中的A(填序号).A.Na2SO3溶液 B.H2O C.NaOH溶液 D.CCl4
(3)溴乙烷在NaOH水溶液和NaOH乙醇溶液发生不同类型的反应,生成不同的产物,用如图2所示装置进行实验:
该实验的目的是验证生成的气体是乙烯(或验证溴乙烷与NaOH发生消去反应的产物).盛水的试管(装置)的作用是除去挥发出来的乙醇蒸气.
(4)为检验溴乙烷中的溴元素,正确的操作顺序是:取少量溴乙烷,然后④①⑤③②④①⑤③②(填序号).
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
(5)经提纯最终得到纯净的溴乙烷为7.63g,则溴乙烷的产率为70%(保留两位有效数字).
分析 圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,小火加热,使NaBr充分反应,利用醇能与HX酸反应的原理制备溴乙烷,涉及溴的物理性质是红棕色液体,易挥发,可通过水溶加热的方法控制反应温度,反应后的混合物因有机物与无机溶液不相溶而分层,下层为密度大于水的溴乙烷,通过分液分离后再进一步进行分离提纯;
(1)溴乙烷的沸点低易挥发,浓硫酸具有强氧化性,温度过高会把溴离子氧化成红棕色的溴;溴乙烷沸点为38.4℃,同时考虑到浓硫酸的强氧化性,为避免更多的副反应进行,只要控制温度略高于38.4℃即行,因此可以通过水浴进行加热就可以了;
(2)分液后,溴乙烷中混有溴,除杂时注意溴和溴乙烷的性质角度考虑,溴单质和氢氧化钠溶液反应;
(3)溴乙烷在NaOH水溶液和NaOH乙醇溶液发生不同类型的反应,生成不同的产物,溴乙烷在NaOH水溶液中生成乙醇,NaOH乙醇溶液发生反应发生消去反应生成乙烯,乙醇通过高锰酸钾溶液也会褪色;
(4)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成;有溴乙烷参加的主要反应是溴乙烷和碱溶液中的水解;
(5)产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)溴乙烷的沸点低易挥发,反应时若温度过高会降低溴乙烷的产率,由于浓硫酸具有强氧化性,能氧化Br-,会有溴生成,看到有红棕色气体产生化学式为Br2,可以利用水浴加热来控制反应温度,
故答案为:溴乙烷的沸点低易挥发;Br2;水浴;
(2)粗制的C2H5Br呈棕黄色,说明含有单质溴杂质,则
A.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,故A正确;
B.溴在溴乙烷中的溶解度比在水中大,加水难以除去溴乙烷中的溴,故B错误;
C.氢氧化钠溶液显示碱性,可以除去杂质溴,但溴乙烷也会在此溶液里发生水解反应,故C错误;
D.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,故D错误;
故答案为:A;
(3)溴乙烷在NaOH水溶液和NaOH乙醇溶液发生不同类型的反应,生成不同的产物,溴乙烷在NaOH水溶液中生成乙醇,NaOH乙醇溶液发生反应发生消去反应生成乙烯,乙醇通过高锰酸钾溶液也会褪色,该实验的目的是验证生成的气体是乙烯 ( 或验证溴乙烷与NaOH发生消去反应的产物 ),盛水的试管(装置)的作用是除去挥发出来的乙醇蒸气,防止干扰乙烯的检验,
故答案为:验证生成的气体是乙烯 ( 或验证溴乙烷与NaOH发生消去反应的产物 );除去挥发出来的乙醇蒸气;
(4)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为④①⑤③②,
故答案为:④①⑤③②;
(5)圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,n(NaBr)=$\frac{10.3g}{103g/mol}$=0.1mol,小火加热,使NaBr充分反应,依据化学方程式定量关系计算,CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O,理论上生成0.1molCH3CH2Br,质量=0.1mol×109g/mol=10.9g
经提纯最终得到纯净的溴乙烷为7.63g,则溴乙烷的产率=$\frac{7.63g}{10.9g}$×100%=70%,
故答案为:70%.
点评 本题主要考查了溴乙烷的制备,掌握相关物质的基本化学性质,是解答本题的关键,平时须注意积累相关反应知识,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
(2)达到平衡时v(NO)为0.002mol/(L.s).
(3)能说明该反应已达到平衡状态的是be.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.NO、O2、NO2的浓度之比为2:1:2 d.容器内密度保持不变
e.容器内气体的颜色不再变化.
回答下列问题:
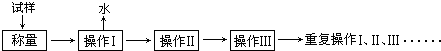
(1)以下是实验中可能用到的几种仪器,请在图下方横线上写出仪器名称.
a.
 电子天平 b.
电子天平 b.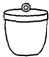 坩埚 c.
坩埚 c.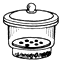 干燥器 d.
干燥器 d.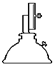 酒精喷灯
酒精喷灯①“操作I”是灼烧硫酸铜晶体,用到上述bd(填序号)仪器.
②“操作Ⅱ”的操作是冷却,必须在c(填序号)中进行.
(2)“重复操作Ⅰ、Ⅱ、Ⅲ”,称为恒重操作.
判断达到恒重的依据是相邻两次称量的质量差小于0.001g;
进行恒重操作的目的是确保晶体失去全部结晶水.
(3)某学生实验后得到以表数据:
| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
| 5.200g | 7.900g | 6.900g |
②该学生测定结果偏高(填“偏高”、“偏低”或“正确”).
③从下列分析中选出该学生产生实验误差的原因可能是(填序号)c.
a.没有进行恒重操作
b.加热固体到白色后,露置在空气中冷却
c.加热过程中晶体有少量溅失
d.加热后在干燥器中冷却至室温后称量.

请回答下列问题:
(1)煅烧前需将黄铁矿粉碎,其目的是充分燃烧,提高原料的利用率.
(2)煅烧造气过程中,若每生成1molSO2气体放出427.5kJ热量,煅烧反应的热化学反应方程式是4FeS2(s)+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ/mol.
(3)催化氧化是一个可逆反应,下表是不同条件下的SO2平衡的转化率:
| SO2的转化率% | 0.1MPa | 1MPa | 10MPa |
| 400°C | 99.2 | 99.7 | 99.9 |
| 600°C | 73.7 | 89.5 | 96.4 |
(4)吸收尾气过程常用NaOH溶液来吸收SO2,若在30L 0.1mol•L-1 的NaOH溶液中通入标准状况下44.8L SO2气体,其反应的离子方程式为3OH-+2SO2=SO32-+HSO3-+H2O,反应后的溶液pH<7,则溶液中离子浓度由大到小的顺序是c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-).
(5)另一种将SO2转化为硫酸的化工流程如图2.其中催化剂a表面的反应是SO2+2H2O-2e-═SO42-+4H+,该流程理论上参加反应的SO2与加入的H2O的质量比为8:15.
| A. | 加热、冷却、称量,重复两次即是恒重操作 | |
| B. | 瓷坩埚加热后冷却时,必须放在干燥器中 | |
| C. | 加热晶体时先用小火,后渐改为用大火加热 | |
| D. | 加热时如晶体爆溅出坩埚,应再加一些晶体 |
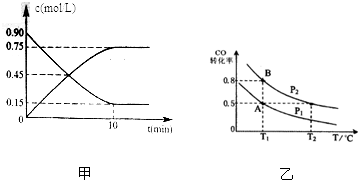
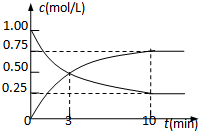 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应: