题目内容
1.标准状况下,5 mL O2和6 mL NO2在试管中组成混合气体,然后将试管倒立在水槽中,充分反应后,试管中剩余气体及其标准状况下的体积是( )| A. | 2.5 mL O2 | B. | 1.5 mL NO2 | C. | 2 mL NO | D. | 3.5 mL O2 |
分析 NO2和O2混合气体与水发生反应:4NO2+O2+2H2O=4HNO3,由方程式可知氧气有剩余,根据方程式计算参加反应氧气体积,进而计算剩余氧气体积.
解答 解:NO2和O2混合气体与水发生反应:4NO2+O2+2H2O=4HNO3,由方程式可知6mL NO2完全消耗氧气体积为6mL×$\frac{1}{4}$=1.5mL<5mL,故氧气有剩余,剩余氧气体积为5mL-1.5mL=3.5mL,
故选:D.
点评 本题考查化学方程式计算,涉及过量计算,注意利用总反应方程式计算解答,比较基础.

练习册系列答案
相关题目
11.下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:1的是( )
| A. | 对二甲苯 | B. | 2-丙醇 | C. | 2-甲基丙烯 | D. | 均三甲苯 |
12.在醋酸溶液中,CH3COOH的电离达到平衡状态的标志是( )
| A. | c(H+)=c(CH3COO-) | |
| B. | 溶液中:c(H+)>c(OH-) | |
| C. | CH3COOH分子的浓度不再变化 | |
| D. | 溶液中同时存在H+、CH3COO-、OH-、CH3COOH、H2O |
16.下列关于等质量的14CO2与N218O说法不正确的是( )
| A. | 分子数之比为1:1 | B. | 原子数之比为1:1 | C. | 中子数之比为1:1 | D. | 密度之比为1:1 |
6.常温下,氮的氧化物(NOx)中除五氧化二氮为固体外,其余均为气体.五氧化二氮的熔点为30℃,则等质量的N2O、N0、N2O5三种物质在常温下体积的大小顺序是( )
| A. | N2O>NO>N2O5 | B. | NO>N2O>N2O5 | C. | N2O5>NO>N2O | D. | N2O5>N2O>NO |
10.某香精的结构简式为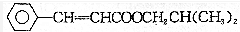 ,下列有关说法中错误的是( )
,下列有关说法中错误的是( )
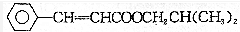 ,下列有关说法中错误的是( )
,下列有关说法中错误的是( )| A. | 在碱溶液中易变质 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 分子式为C13H16O2 | |
| D. | 与HCl恰好完全加成时可得到一种纯净物 |
17.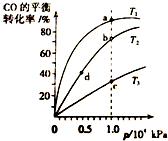 用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
 用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A. | 温度:T1>T2>T3 | B. | 正反应速率:v(a)>v(c) v(b)>v(d) | ||
| C. | 平衡常数:K(a)>K(b) K(b)=K(d) | D. | 平均摩尔质量:M(a)>M(c) M(b)<M(d) |