题目内容
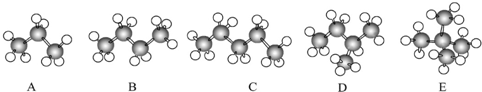
15.A、B、C、D、E代表五种元素.回答下列问题:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为N;
(2)B元素的一价阴离子和C元素的一价阳离子的电子层排布均与氩相同,则B的元素符号为Cl,C的元素符号为K.
(3)D元素的三价阳离子的3d轨道为半充满,则其元素符号为Fe,D的基态原子电子排布式为1s22s22p63s23p63d64s2.
(4)E元素基态原子的电子排布是前四周期中未成对电子最多的,则其元素符号为Cr,E的外围电子排布式为3d54s1.
分析 (1)次外层有2个电子,则有2个电子层;
(2)在原子中,核电荷数=核内质子数=核外电子数,B元素原子的核电荷数为n,X得到1个电子后变为B-,C失去1个电子后变为C+,根据电子层结构相同,即核外电子数相同,列出等式求解即可;
(3)D元素的正三价离子的3d轨道为半充满,3d轨道电子数为5,应为Fe元素;
(4)E元素基态原子的电子排布是前四周期中未成对电子最多的,则E原子价电子排布式为3d54s1,据此分析判断.
解答 解:(1)基态原子的最外层有3个未成对电子,次外层有2个电子的元素符号为N,其电子排布式为:1s22s22p3,故答案为:N;
(2)设元素B的核电荷数是a,C元素原子的核电荷数为b,因为阴离子B-与阳离子C+电子层结构都与氩相同相同,即核外电子数相同,所以a=18-1=17,b=18+1=19,所以B是Cl,C为K原子,故答案为:Cl;K;
(3)D元素的正三价离子的3d轨道为半充满,3d轨道电子数为5,则基态原子的电子排布式为1s22s22p63s23p63d64s2,应为Fe元素,故答案为:Fe;1s22s22p63s23p63d64s2;
(4)E元素基态原子的电子排布是前四周期中未成对电子最多的,则E原子价电子排布式为3d54s1,所以该原子的电子排布式为1s22s22p63s23p63d54s1,则质子数为24,为Cr元素,故答案为:Cr;3d54s1.
点评 本题考查了元素推断及原子核外电子排布式的书写,熟悉原子结构及电子排布式规则是解本题关键,先根据题干信息确定元素,再根据构造原理书写核外电子排布式,题目难度不大.

练习册系列答案
相关题目
6.下列反应中,不属于氧化还原反应是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝与稀盐酸反应 | ||
| C. | 灼热的炭与CO2反应 | D. | CO与O2燃烧反应 |
10.下列各轨道能量由低到高排列的是( )
| A. | 1s 2p 3s 3d | B. | 2s 2px 2py 2pz | C. | 1s 3s 3d 4s | D. | 4f 3p 2p 1s |
20.下列分离方法中,正确的是( )
①用蒸馏法分离乙醇和水的混合物
②用升华法分离碘和砂子的混合物
③用重结晶法提纯苯甲酸
④用分液法分离苯和溴苯的混合物.
①用蒸馏法分离乙醇和水的混合物
②用升华法分离碘和砂子的混合物
③用重结晶法提纯苯甲酸
④用分液法分离苯和溴苯的混合物.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
7.下列各组混合物中,不能互溶的是( )
| A. | 乙醇和碘水 | B. | 乙醇和乙酸 | C. | 甲醛和水 | D. | 苯和水 |
4.我国某城市的空气成分有①N2 ②①N2 ②O2 ③CO2 ④Ar ⑤SO2 ⑥NO2 ⑦颗粒物.其中能导致酸雨的是( )
| A. | ⑤⑥ | B. | ③⑤⑦ | C. | ④⑤⑦ | D. | ③④⑤⑥⑦ |
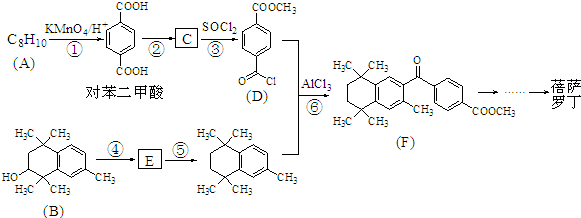
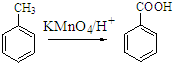
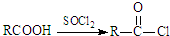
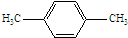 ;原料B发生反应④所需的条件为浓硫酸、加热.
;原料B发生反应④所需的条件为浓硫酸、加热.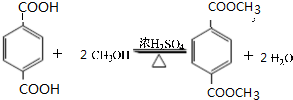 ;⑤
;⑤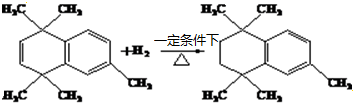 .
. .
.