题目内容
将0.01mol?L-1的HAc与0.01mol?L-1的 NaAc 溶液等体积混合,已知该混合溶液中c(Na+)<c(Ac-),(用“>、=、<”填空).
(1)0.01mol?L-1 HAc的pH 2 (2)c(OH-) c(H+);
(3)c(HAc) c(Ac-); (4)c(HAc)+c(Ac-) 0.01mol?L-1.
(1)0.01mol?L-1 HAc的pH
(3)c(HAc)
分析:根据电荷守恒可知:c(Na+)+c(H+)=c(Ac-)+c(OH-),已知该混合溶液中c(Na+)<c(Ac-),所以c(H+)>c(OH-),说明的电离程度大于NaAc中Ac-离子的水解程度,溶液中c(HAc)<c(Ac-);根据乙酸为弱酸,溶液中部分电离判断溶液的pH;根据物料守恒判断c(HAc)+c(Ac-)的浓度之和.
解答:解:将0.01mol?L-1的HAc与0.01mol?L-1的 NaAc 溶液等体积混合,已知该混合溶液中c(Na+)<c(Ac-),根据电荷守恒c(Na+)+c(H+)=c(Ac-)+c(OH-)可知,溶液中c(H+)>c(OH-),溶液显示酸性,
(1)醋酸为弱电解质,溶液中部分电离出氢离子,所以0.01mol?L-1 HAc溶液中氢离子浓度小于0.01mol?L-1,溶液的pH>2,故答案为:>;
(2)已知该混合溶液中c(Na+)<c(Ac-),根据电荷守恒c(Na+)+c(H+)=c(Ac-)+c(OH-)可知,溶液中c(H+)>c(OH-),故答案为:<;
(3)醋酸的电离程度大于NaAc中Ac-离子的水解程度,溶液中c(HAc)<c(Ac-),故答案为:<;
(4)设溶液体积为V,根据物料守恒,n(HAc)+n(Ac-)=n(Na+)V+n原溶液(HAc)V=0.02Vmol,c(HAc)+c(Ac-)=
=0.01mol?L-1,
故答案为:=.
(1)醋酸为弱电解质,溶液中部分电离出氢离子,所以0.01mol?L-1 HAc溶液中氢离子浓度小于0.01mol?L-1,溶液的pH>2,故答案为:>;
(2)已知该混合溶液中c(Na+)<c(Ac-),根据电荷守恒c(Na+)+c(H+)=c(Ac-)+c(OH-)可知,溶液中c(H+)>c(OH-),故答案为:<;
(3)醋酸的电离程度大于NaAc中Ac-离子的水解程度,溶液中c(HAc)<c(Ac-),故答案为:<;
(4)设溶液体积为V,根据物料守恒,n(HAc)+n(Ac-)=n(Na+)V+n原溶液(HAc)V=0.02Vmol,c(HAc)+c(Ac-)=
| 0.02Vmol |
| VL |
故答案为:=.
点评:本题考查弱电解质的电离平衡及溶液中离子浓度大小比较,题目难度中等,该类试题是历年高考热点,主要考查溶液中电荷守恒和物料守恒的应用、弱电解质的电离平衡,把这些理论知识与探究实验结合是今后命题的趋势,能很好考查学生的发散思维能力.

练习册系列答案
相关题目
下列述叙正确的是( )
| A、取一小块铝箔用砂纸打磨除去表面的氧化膜后,在酒精灯上加热灼烧,可看到铝箔燃烧起来火星四溅 | B、Mg(OH)2的悬浊液中加入NH4Cl溶液后变澄清,是因为Mg(OH)2的Ksp在NH4Cl溶液中变大 | C、将0.01mol/L KMnO4的酸性溶液滴入0.1mol/L H2C2O4溶液中,紫红色褪去的速率会逐渐加快 | D、将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色 |
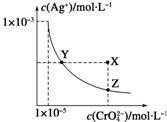 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法不正确的是( )
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法不正确的是( )