题目内容
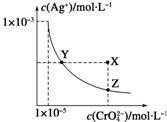 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法不正确的是( )
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法不正确的是( )分析:A、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,溶度积是饱和溶液中离子浓度幂次方的乘积;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上;
C、一定温度下溶度积是常数,随温度变化,不随浓度变化;
D、依据溶液中离子浓度结合溶度积常数计算银离子浓度,银离子浓度越小先析出沉淀;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上;
C、一定温度下溶度积是常数,随温度变化,不随浓度变化;
D、依据溶液中离子浓度结合溶度积常数计算银离子浓度,银离子浓度越小先析出沉淀;
解答:解:A、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)?2Ag+CrO42-;
Ksp=c2(Ag+)c(CrO42-)=(10-3)2?10-3=10-9;故A错误;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故B正确;
C、一定温度下溶度积是常数,随温度变化,不随浓度变化,所以t℃时,Y点和Z点时Ag2CrO4的Ksp相等,故C正确;
D、依据溶度积常数计算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-9;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L
KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)=
=
×10-4mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=
=1.8×10-8mol/L,所以先析出氯化银沉淀,故D正确;
故选A;
Ksp=c2(Ag+)c(CrO42-)=(10-3)2?10-3=10-9;故A错误;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故B正确;
C、一定温度下溶度积是常数,随温度变化,不随浓度变化,所以t℃时,Y点和Z点时Ag2CrO4的Ksp相等,故C正确;
D、依据溶度积常数计算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-9;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L
KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)=
|
| 10 |
| 1.8×10-10 |
| 0.01 |
故选A;
点评:本题考查了沉淀溶解平衡的分析判断,溶度积常数的计算应用,溶度积是随温度变化,题目难度中等.

练习册系列答案
相关题目
在t℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12.向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如下表所示.
|
 在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
 2AgCl(s)+CrO
2AgCl(s)+CrO
 2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107