题目内容
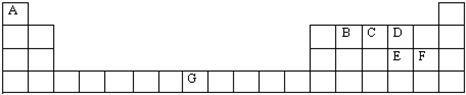
下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素.
(1)A与D可组成某四原子的极性分子,该分子的电子式是 ;
(2)C与E的最高价氧化物对应的水化物的酸性强弱情况是 (选编号)
a.E是强酸,C是弱酸 b.C是强酸,E是弱酸 c.都是强酸,酸性相当
以上两种酸的沸点差异还是比较大的,其沸点较高的是 写化学式).
(3)由AB两种元素组成原子个数比为1:1、1:2、1:3的化合物的化学式 (各写一种).
(4)G是一种常见金属,其单质与水蒸汽反应的化学方程式为 .

(1)A与D可组成某四原子的极性分子,该分子的电子式是
(2)C与E的最高价氧化物对应的水化物的酸性强弱情况是
a.E是强酸,C是弱酸 b.C是强酸,E是弱酸 c.都是强酸,酸性相当
以上两种酸的沸点差异还是比较大的,其沸点较高的是
(3)由AB两种元素组成原子个数比为1:1、1:2、1:3的化合物的化学式
(4)G是一种常见金属,其单质与水蒸汽反应的化学方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知A为氢、B为碳、C为氮、D为氧、E为硫、F为Cl、G为Fe.
(1)A与D可组成某四原子的极性分子为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对;
(2)C与E的最高价氧化物对应的水化物分别为硝酸、硫酸,都是强酸,硝酸为挥发性酸,而硫酸为高沸点酸;
(3)由H、C两种元素组成原子个数比为1:1、1:2、1:3分别为C2H2、C2H4、C2H6等;
(4)Fe与水蒸气在高温下反应生成四氧化三铁与氢气.
(1)A与D可组成某四原子的极性分子为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对;
(2)C与E的最高价氧化物对应的水化物分别为硝酸、硫酸,都是强酸,硝酸为挥发性酸,而硫酸为高沸点酸;
(3)由H、C两种元素组成原子个数比为1:1、1:2、1:3分别为C2H2、C2H4、C2H6等;
(4)Fe与水蒸气在高温下反应生成四氧化三铁与氢气.
解答:
解:由元素在周期表中位置,可知A为氢、B为碳、C为氮、D为氧、E为硫、F为Cl、G为Fe.
(1)A与D可组成某四原子的极性分子为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,其电子式为: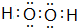 ,
,
故答案为: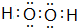 ;
;
(2)C与E的最高价氧化物对应的水化物分别为硝酸、硫酸,都属于强酸,硝酸为挥发性酸,而硫酸为高沸点酸,故H2SO4的沸点较高,故答案为:c;H2SO4;
(3)由H、C两种元素组成原子个数比为1:1、1:2、1:3分别为C2H2、C2H4、C2H6等,故答案为:C2H2、C2H4、C2H6;
(4)Fe与水蒸气在高温下反应生成四氧化三铁与氢气,反应方程式为:3Fe+4H2O(g)
Fe3O4+4H2,故答案为:3Fe+4H2O(g)
Fe3O4+4H2.
(1)A与D可组成某四原子的极性分子为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,其电子式为:
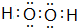 ,
,故答案为:
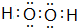 ;
;(2)C与E的最高价氧化物对应的水化物分别为硝酸、硫酸,都属于强酸,硝酸为挥发性酸,而硫酸为高沸点酸,故H2SO4的沸点较高,故答案为:c;H2SO4;
(3)由H、C两种元素组成原子个数比为1:1、1:2、1:3分别为C2H2、C2H4、C2H6等,故答案为:C2H2、C2H4、C2H6;
(4)Fe与水蒸气在高温下反应生成四氧化三铁与氢气,反应方程式为:3Fe+4H2O(g)
| ||
| ||
点评:本题考查元素周期表、电子式、元素化合物性质等,难度不大,注意对基础知识的全面掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:
Na3N+H2O→NaOH+NH3
NaH+H2O→NaOH+H2
有关它们的叙述正确的是( )
Na3N+H2O→NaOH+NH3
NaH+H2O→NaOH+H2
有关它们的叙述正确的是( )
| A、离子半径:N3->Na+>H+ |
| B、与水反应都是氧化还原反应 |
| C、与盐酸反应都只生成一种盐 |
| D、两种化合物中的阴阳离子均具有相同的电子层结构 |
下列有关化学用语表示正确的是( )
A、中子数为20的氯原子:
| ||
B、CO2的比例模型: | ||
C、铝原子的结构示意图: | ||
D、聚丙烯的结构简式: |
下列方程式书写正确的是( )
| A、实验室制取H2:2Fe+6HCl═2FeCl3+3H2↑ | ||||
| B、实验室制取CO2:CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||||
| C、把铜丝伸入硫酸亚铁溶液:Cu+FeSO4═Fe+CuSO4 | ||||
D、甲烷完全燃烧:CH4+O2
|
决定气体体积的主要因素是:①气体分子直径②所含微粒数 ③气体相对分子质量 ④微粒间的距离( )
| A、只②③④ | B、只②④ |
| C、只①③④ | D、①②③④全部 |
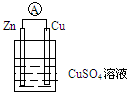 根据如图装置回答:
根据如图装置回答: