题目内容
根据原子结构及元素周期律的知识,下列推断正确的是( )
A、
| ||||
| B、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 | ||||
| D、核外电子排布相同的微粒化学性质也相同 |
考点:原子结构与元素周期律的关系
专题:
分析:A.互为同位素原子的化学性质几乎完全相同;
B.同主族元素最高价含氧酸自上而下酸性减弱;
C.电子层结构相同,核电荷数越大离子半径越小;
D.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子与S2-离子.
B.同主族元素最高价含氧酸自上而下酸性减弱;
C.电子层结构相同,核电荷数越大离子半径越小;
D.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子与S2-离子.
解答:
解:A.3517Cl与3717Cl互为同位素,化学性质几乎完全相同,电子能力相同,故A错误;
B.同主族元素最高价含氧酸自上而下酸性减弱,不是最高价含氧酸不一定,如HClO为弱酸、HBrO4为强酸,故B错误;
C.S2-、Cl-、Ca2+、K+电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl->K+>Ca2+,故C错误;
D.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子化学性质稳定,而S2-离子具有强还原性,故D正确,
故选A.
B.同主族元素最高价含氧酸自上而下酸性减弱,不是最高价含氧酸不一定,如HClO为弱酸、HBrO4为强酸,故B错误;
C.S2-、Cl-、Ca2+、K+电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl->K+>Ca2+,故C错误;
D.核外电子排布相同的微粒,化学性质不一定相同,如Ar原子化学性质稳定,而S2-离子具有强还原性,故D正确,
故选A.
点评:本题考查同主族元素性质递变规律、微粒半径比较、原子结构与性质关系等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
标准状况下,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,充入时体积如图所示,若将装置右边H2、O2的混合气体点燃引爆,活塞先左弹,恢复至原温度后,活塞右滑最终停在容器的正中央,则原来H2、O2的体积比最接近于( )
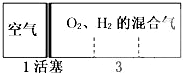
①2:7 ②5:4 ③4:5 ④7:2.
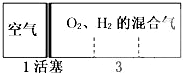
①2:7 ②5:4 ③4:5 ④7:2.
| A、①② | B、②④ | C、③④ | D、①③ |
下列说法正确的是( )
| A、HIO与HCN均为含有极性键的直线形极性分子 |
| B、SiO2与C02均为每摩含有4×6.02×1023对共用电子对的酸性氧化物 |
| C、Na2S浓溶液与稀盐酸分别滴加到饱和AgCl溶液中均一定有沉淀产生 |
| D、明矾与离子交换树脂均能将海水进行淡化 |
下列各组物质中一定互为同系物的是( )
| A、C2H2,苯 |
| B、C2H4,C8H8 |
| C、CH4,C4H10 |
| D、C2H6,C2H6O |
对可逆反应4A(g)+5B(g)?4C(g)+6D(g)△H>0,下列叙述中,正确的是( )
| A、化学反应速率关系是:2v正(A)=3v正(D) |
| B、若单位时间内生成x mol C的同时,消耗x mol A,则反应一定处于平衡状态 |
| C、达到化学平衡后,增大容器的容积,则正反应速率减小,逆反应速率增大 |
| D、达到化学平衡后,升高温度,则C的质量分数增大 |
短周期元素X、Y、Z、W、Q在周期表中的相对位置如图所示.下列说法不正确的是( )

| A、离子半径的大小顺序为W>Q>Y>Z |
| B、X、Y、W三种元素的电负性大小顺序为X>Y>W |
| C、X、Z、W三种元素的最高价氧化物对应的水化物均能与强碱反应 |
| D、元素X的最简单氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
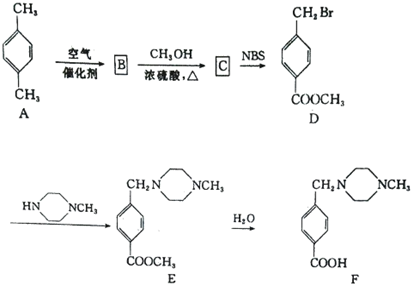
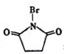 ,则反应C→D的化学方程式为
,则反应C→D的化学方程式为