题目内容
7.已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol,在一定温度的密闭容器中充入2molSO2 和1molO2充分反应,达到平衡状态时最终放出的热量为98.32kJ,则平衡时容器中的压强与起始时压强的比值为( )| A. | $\frac{3}{2}$ | B. | $\frac{2}{3}$ | C. | $\frac{6}{5}$ | D. | $\frac{5}{6}$ |
分析 达到平衡状态时最终放出的热量为98.32kJ,说明转化的SO2为1mol,结合方程式计算平衡时混合气体总物质的量,容器压强之比等于气体物质的量之比.
解答 解:达到平衡状态时最终放出的热量为98.32kJ,说明转化的SO2为1mol,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 1 0
转化量(mol):1 0.5 1
平衡量(mol):1 0.5 1
容器压强之比等于气体物质的量之比,则衡时容器中的压强与起始时压强的比值为$\frac{(1+0.5+1)mol}{(2+1)mol}$=$\frac{5}{6}$,
故选:D.
点评 本题考查化学平衡计算,比较基础,注意三段式解题法在化学平衡计算中应用,有利于基础知识的巩固.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下表中是各组反应的反应物和温度,反应刚开始时,放出氢气速率最快的是( )
| 编号 | 金属(粉末状)mol | 酸的浓度及体积 | 反应温度(℃) |
| A | Mg,0.1 | 6mol/L硝酸10ml | 80 |
| B | Mg,0.1 | 3mol/L盐酸10ml | 60 |
| C | Fe,0.1 | 3mol/L盐酸10ml | 60 |
| D | Mg,0.1 | 3mol/L硫酸10ml | 60 |
| A. | A | B. | B | C. | C | D. | D |
12.用中和滴定测定某盐酸的浓度,操作如下:用天平秤得20gNaOH,配成1000ml标准溶液,用来测定大约浓度为1mol/L的盐酸50mL,假设配得的NaOH溶液直接用来测定,该实验允许误差为一滴(约0.05mL),那么称取NaOH固体的天平的准确度在下列数据中中哪个比较合理( )
| A. | 0.1g | B. | 0.01g | C. | 0.001g | D. | 0.0001g |
19.全钒液流电池是一种新型的绿色环保储能电池.其电池总反应为:
V3++VO2++H2O VO2++2H++V2+,下列说法正确的是( )
VO2++2H++V2+,下列说法正确的是( )
V3++VO2++H2O
 VO2++2H++V2+,下列说法正确的是( )
VO2++2H++V2+,下列说法正确的是( )| A. | 放电时每转移2mol电子时,消耗1mol氧化剂 | |
| B. | 放电时正极反应为:VO+2+2H++e-=VO2++H2O | |
| C. | 放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极 | |
| D. | 充电过程中,H+由阴极区移向阳极区迁移 |
16.下列反应的离子方程式书写正确的是( )
| A. | 用氨水吸收少量SO2气体:NH3•H2O+SO2→NH4++HSO3- | |
| B. | FeI2溶液中通入Cl2至Fe2+恰好完全被氧化:2Fe2++Cl2→2Fe3++2Cl- | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-→CO32-+H2O | |
| D. | 在Ca(ClO)2溶液中通入足量的CO2气体:ClO-+CO2+H2O→HClO+HCO3- |
 ,那么 1mol该烃完全燃烧需消耗氧气的量为18.5mol.
,那么 1mol该烃完全燃烧需消耗氧气的量为18.5mol.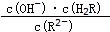 将减小(填“增大”或“减小”或“不变”或“无法判断”)
将减小(填“增大”或“减小”或“不变”或“无法判断”)