题目内容
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、80g硝酸铵含有氮原子数为2NA |
| B、1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA |
| C、标准状况下,11.2L SO3所含分子数为0.5 NA |
| D、0.1mol FeCl3加入沸水中,全部制得Fe(OH)3胶体,胶体粒子数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、根据n=
并结合NH4NO3的化学式来分析计算;
B、HCl气体溶于水后,在水分子的作用下发生了完全电离;
C、在标况下,三氧化硫为固体;
D、Fe(OH)3胶粒是多个Fe(OH)3的聚集体.
| m |
| M |
B、HCl气体溶于水后,在水分子的作用下发生了完全电离;
C、在标况下,三氧化硫为固体;
D、Fe(OH)3胶粒是多个Fe(OH)3的聚集体.
解答:
解:A、80gNH4NO3的物质的量n=
=
=1mol,而根据硝酸铵的化学式NH4NO3可知,1molNH4NO3含2mol氮原子,即2NA个,故A正确;
B、HCl气体溶于水后,在水分子的作用下发生了完全电离,故盐酸溶液中无HCl分子,故B错误;
C、在标况下,三氧化硫为固体,故C错误;
D、胶体粒子是大量氢氧化铁的聚集体,所以含0.1mol FeCl3溶质的溶液形成胶体后,胶体粒子小于0.1NA,故D错误;
故选A.
| m |
| M |
| 80g |
| 80g/mol |
B、HCl气体溶于水后,在水分子的作用下发生了完全电离,故盐酸溶液中无HCl分子,故B错误;
C、在标况下,三氧化硫为固体,故C错误;
D、胶体粒子是大量氢氧化铁的聚集体,所以含0.1mol FeCl3溶质的溶液形成胶体后,胶体粒子小于0.1NA,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用以及物质的结构是关键,难度不大.

练习册系列答案
相关题目
下列物质中不能有两种单质直接反应生成的是( )
| A、Na2O |
| B、Na2O2 |
| C、Fe3O4 |
| D、FeCl2 |
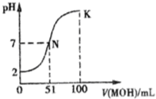 常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中不正确的是( )
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中不正确的是( )| A、HA为一元强酸 | ||
| B、N点水的电离程度小于K点水的电离程度 | ||
C、随着MOH溶液的滴加,比值
| ||
| D、若K点对应的溶液的PH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L |
若在加入铝粉能放出氢气的溶液中分别加入下列各组离子,可能共存的是( )
| A、Ag+ K+ Ba2+ I- |
| B、[Al(OH)4]- S2- HCO3-Na+ |
| C、NH4+Fe3+Cl-SO42- |
| D、Fe2+Cu2+Mg2+NO3- |
下列事实中不能应用勒夏特列原理来解释的是( )
| A、新制的氯水在光照条件下颜色变浅 |
| B、加入催化剂能使合成氨的速率加快 |
| C、高压对合成氨有利 |
| D、室温比500℃左右更有利于合成氨的反应 |
已知下列元素的原子半径
根据以上数据,磷原子的半径(10-10m)可能是( )
| 原子 | N | S | O | Si |
| 半径(10-10m) | 0.75 | 1.02 | 0.74 | 1.17 |
| A、0.80 | B、1.10 |
| C、1.20 | D、0.70 |