题目内容
利用废旧铝合金(主要成分:Al、Fe、Mg)易拉罐制备钾明矾晶体[KAl(SO4)2?12H2O,式量474].制备步骤如下:
步骤1、铝片的准备
①去除易拉罐表面的漆膜:②用剪刀剪成小铝片,称2克备用
步骤2、钾明矾的制备
方案一:
方案二:
相关信息如下:
①钾明矾为正八面体晶型,有玻璃光泽,密度1.757g/cm3熔点92.5℃.64.5℃时失去9分子结晶水,200℃时失去12分子结晶水,溶于水,难溶于乙醇.
②相关物质的溶解度:
请回答下列问题:
(1)下列方法不能去除易拉罐表面漆膜(主要成分为烃类化合物)的方法是
A.灼烧 B.饱和碳酸钠溶液浸泡 C.砂纸打磨 D.有机溶荆浸泡
(2)方案一中的硫酸浓度不宜过稀也不宜过浓,原因是 ;蒸发浓缩后的操作步骤是 、 、洗涤、干燥;干燥时应控制温度 .
(3)实际实验中往往采用方案二,写出其可能的两条理由 ;方案二制备钾明矾晶体时不再加入K2SO4饱和溶液的原因是 (用方程式表示).
(4)下列关于抽滤的说法正确的是 .
A.该方法适用于所有固体与液体的分离
B.向布氏漏斗中转移混合物时应先用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
C.抽滤中的吸滤瓶外表形状与锥形瓶十分相似,但厚度要比锥形瓶要厚一些
D.安装好仪器,将滤纸放入布氏漏斗内,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上
(5)最后得到钾明矾晶体质量为31.5g,产率为 .(保留3位有效数字)
步骤1、铝片的准备
①去除易拉罐表面的漆膜:②用剪刀剪成小铝片,称2克备用
步骤2、钾明矾的制备
方案一:

方案二:

相关信息如下:
①钾明矾为正八面体晶型,有玻璃光泽,密度1.757g/cm3熔点92.5℃.64.5℃时失去9分子结晶水,200℃时失去12分子结晶水,溶于水,难溶于乙醇.
②相关物质的溶解度:
| 物质/温度℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| K2SO4 | 7.4 | 9.2 | 11.1 | 12.97 | 14.8 | 16.6 | 18.7 | 19.8 | 21.4 | 22.4 | 24.1 |
| Al2(SO4)3?18H2O | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 | 59.2 | 66.2 | 73.1 | 86.8 | 89.0 |
| KAl(SO4)2?12H2O | 3.0 | 4.0 | 5.9 | 8.4 | 11.7 | 17.0 | 24.8 | 40.0 | 71.0 | 109.0 | 154.0 |
(1)下列方法不能去除易拉罐表面漆膜(主要成分为烃类化合物)的方法是
A.灼烧 B.饱和碳酸钠溶液浸泡 C.砂纸打磨 D.有机溶荆浸泡
(2)方案一中的硫酸浓度不宜过稀也不宜过浓,原因是
(3)实际实验中往往采用方案二,写出其可能的两条理由
(4)下列关于抽滤的说法正确的是
A.该方法适用于所有固体与液体的分离
B.向布氏漏斗中转移混合物时应先用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
C.抽滤中的吸滤瓶外表形状与锥形瓶十分相似,但厚度要比锥形瓶要厚一些
D.安装好仪器,将滤纸放入布氏漏斗内,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上
(5)最后得到钾明矾晶体质量为31.5g,产率为
考点:制备实验方案的设计,铝的化学性质
专题:几种重要的金属及其化合物
分析:(1)易拉罐表面漆膜(主要成分为烃类化合物),根据烃类化合物的性质分析;
(2)根据浓度对反应速率的影响,以及浓硫酸使Al钝化的性质分析;从溶液中提取溶质晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;温度在64.5℃时钾明矾晶体会失去9分子结晶水;
(3)方案一加硫酸溶解时,Mg、Fe均转化为易溶性的硫酸盐,方案一中反应速率较慢;K[Al(OH)4]和H2SO4反应会生成K2SO4;
(4)A.该方法适用于不溶性固体与液体的分离;
B.根据抽滤的操作分析;
C.抽滤时吸滤瓶中压强较小,所以厚度要比锥形瓶要厚一些,防止被大气压压坏;
D.安装好仪器,将滤纸放入布氏漏斗内,滴加蒸馏水使滤纸与漏斗连接紧密;
(5)根据铝原子守恒计算出理论上2克铝完全转化为KAl(SO4)2?12H2O的质量,再用实际的钾明矾晶体质量除以理论值即得到产率.
(2)根据浓度对反应速率的影响,以及浓硫酸使Al钝化的性质分析;从溶液中提取溶质晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;温度在64.5℃时钾明矾晶体会失去9分子结晶水;
(3)方案一加硫酸溶解时,Mg、Fe均转化为易溶性的硫酸盐,方案一中反应速率较慢;K[Al(OH)4]和H2SO4反应会生成K2SO4;
(4)A.该方法适用于不溶性固体与液体的分离;
B.根据抽滤的操作分析;
C.抽滤时吸滤瓶中压强较小,所以厚度要比锥形瓶要厚一些,防止被大气压压坏;
D.安装好仪器,将滤纸放入布氏漏斗内,滴加蒸馏水使滤纸与漏斗连接紧密;
(5)根据铝原子守恒计算出理论上2克铝完全转化为KAl(SO4)2?12H2O的质量,再用实际的钾明矾晶体质量除以理论值即得到产率.
解答:
解:(1)易拉罐表面漆膜(主要成分为烃类化合物),烃类化合物易燃烧、易溶于有机溶剂、易被砂纸打磨掉,所以为了去除易拉罐表面漆膜可以采用灼烧、砂纸打磨、有机溶荆浸泡等方法,烃类化合物难溶于饱和碳酸钠溶液浸泡;
故答案为:B;
(2)浓度越大反应速率越大,则硫酸浓度不能过稀,过稀反应速率过慢,但是浓硫酸能使铝钝化,所以浓度也不能过高;从溶液中提取溶质晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;温度在64.5℃时钾明矾晶体会失去9分子结晶水,所以干燥晶体是时应控制温度64.5℃以下;
故答案为:硫酸浓度过稀反应速率过慢,浓度过高会使铝片钝化;冷却结晶;过滤;64.5℃以下;
(3)方案一加硫酸溶解时,Mg、Fe均转化为易溶性的硫酸盐,制备得到的所以钾明矾晶体中含有较多的杂质;铝与稀硫酸的反应速率较慢,所以方案一中反应速率较慢;K[Al(OH)4]和H2SO4反应会生成K2SO4,其反应的离子方程为:2K[Al(OH)4]+4H2SO4=K2SO4+Al2(SO4)3+8H2O;
故答案为:;2K[Al(OH)4]+4H2SO4=K2SO4+Al2(SO4)3+8H2O;
(4)A.该方法适用于不溶性固体与液体的分离,并不适用于所有的固体与液体的分离,故A错误;
B.向布氏漏斗中转移混合物时应先用倾析法转移溶液,然后开大水龙头,使吸滤瓶中气压减小,加快过滤的速度,待溶液快流尽时再转移沉淀,故B正确;
C.抽滤中的吸滤瓶外表形状与锥形瓶十分相似,抽滤时吸滤瓶中压强较小,所以厚度要比锥形瓶要厚一些,防止被大气压压坏,故C正确;
D.安装好仪器,将滤纸放入布氏漏斗内,滴加蒸馏水使滤纸与漏斗连接紧密,向布氏漏斗中转移混合物后,再开水龙头,抽气,故D错误.
故答案为:BC;
(5)设2克铝完全反应生成的钾明矾晶体质量为xg;
Al~~~~KAl(SO4)2?12H2O
27 474
2g xg
则x=
=35.1g,
所以钾明矾产率为
×100%=89.7%;
故答案为:89.7%.
故答案为:B;
(2)浓度越大反应速率越大,则硫酸浓度不能过稀,过稀反应速率过慢,但是浓硫酸能使铝钝化,所以浓度也不能过高;从溶液中提取溶质晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;温度在64.5℃时钾明矾晶体会失去9分子结晶水,所以干燥晶体是时应控制温度64.5℃以下;
故答案为:硫酸浓度过稀反应速率过慢,浓度过高会使铝片钝化;冷却结晶;过滤;64.5℃以下;
(3)方案一加硫酸溶解时,Mg、Fe均转化为易溶性的硫酸盐,制备得到的所以钾明矾晶体中含有较多的杂质;铝与稀硫酸的反应速率较慢,所以方案一中反应速率较慢;K[Al(OH)4]和H2SO4反应会生成K2SO4,其反应的离子方程为:2K[Al(OH)4]+4H2SO4=K2SO4+Al2(SO4)3+8H2O;
故答案为:;2K[Al(OH)4]+4H2SO4=K2SO4+Al2(SO4)3+8H2O;
(4)A.该方法适用于不溶性固体与液体的分离,并不适用于所有的固体与液体的分离,故A错误;
B.向布氏漏斗中转移混合物时应先用倾析法转移溶液,然后开大水龙头,使吸滤瓶中气压减小,加快过滤的速度,待溶液快流尽时再转移沉淀,故B正确;
C.抽滤中的吸滤瓶外表形状与锥形瓶十分相似,抽滤时吸滤瓶中压强较小,所以厚度要比锥形瓶要厚一些,防止被大气压压坏,故C正确;
D.安装好仪器,将滤纸放入布氏漏斗内,滴加蒸馏水使滤纸与漏斗连接紧密,向布氏漏斗中转移混合物后,再开水龙头,抽气,故D错误.
故答案为:BC;
(5)设2克铝完全反应生成的钾明矾晶体质量为xg;
Al~~~~KAl(SO4)2?12H2O
27 474
2g xg
则x=
| 2g×474 |
| 27 |
所以钾明矾产率为
| 31.5g |
| 35.1g |
故答案为:89.7%.
点评:本题考查了物质的制备实验方案设计,涉及实验方案评价、实验条件的选择、离子方程式的书写、抽滤实验操作、原子守恒在计算中的应用等,题目难度中等,题目考查的知识点较多,侧重于基础知识应用的考查和实验探究能力的考查.

练习册系列答案
相关题目
某浓度的硝酸与过量铁粉反应时生成了4.48LN2O气体(标准状况下),若改与铝反应(生成NO气体),则最后可溶解的铝的质量是( )
| A、13.5g | B、9g |
| C、27g | D、8.9g |
下列说法正确的是( )
①只由一种元素组成的物质,一定是纯净物;
②离子化合物中一定含离子键,可能含共价键,一定含金属元素;
③硝酸和盐酸既有氧化性,又有还原性;
④碱性氧化物一定是金属氧化物.
①只由一种元素组成的物质,一定是纯净物;
②离子化合物中一定含离子键,可能含共价键,一定含金属元素;
③硝酸和盐酸既有氧化性,又有还原性;
④碱性氧化物一定是金属氧化物.
| A、①② | B、①④ | C、②③ | D、③④ |
实验室有一瓶久置的白色K2SO3粉末,为确定其是否被氧化及其成分,元素分析表明粉末中K和S元素的质量比为39:16,下列结论正确的是( )
| A、根据测得的元素质量比可推测该粉末为纯净物 |
| B、将粉末溶于水,加入氯化钡,有白色沉淀生成,证明原粉末含K2SO4 |
| C、将粉末加入盐酸中,产生气泡,证明K2SO3未变质 |
| D、将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成,证明原粉末是K2SO4和K2SO3的混合物 |
 某同学取一张铝箔,并用针刺一些小孔,然后取一药匙过氧化钠粉末,用铝箔包好,放入如图所示装置倒扣的漏斗中.
某同学取一张铝箔,并用针刺一些小孔,然后取一药匙过氧化钠粉末,用铝箔包好,放入如图所示装置倒扣的漏斗中. )是其中的一种,它可以从茉莉花中提取.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取.一种合成路线如下: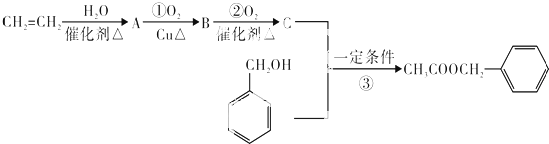
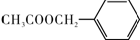 )的说法正确的是
)的说法正确的是 )在一定条件下可以发生如图所示的转化(其它产物和水已略去).请回答下列问题:
)在一定条件下可以发生如图所示的转化(其它产物和水已略去).请回答下列问题: