题目内容
7.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )| A. | 将NaHCO3固体加入新制氯水,有无色气泡(H) | |
| B. | 使红色布条褪色(HCl) | |
| C. | 向氯水中加入CuSO4,变蓝色,(H2O) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl) |
分析 氯气与水反应,发生Cl2+H2O=H++Cl-+HClO,氯水中含有HClO、Cl2,具有氧化性,其中HClO具有漂白性,含有H+,具有酸性,Cl-结合银离子会生成白色沉淀,以此解答.
解答 解:A.氯水显酸性,其中的盐酸能与碳酸氢钠反应生成CO2气体,与氯水成分有关,故A不选;
B.次氯酸具有强氧化性,能氧化有色布条使红色布条褪色,不是HCl的作用,故B选;
C.向氯水中加入CuSO4 ,白色固体硫酸铜溶于水形成蓝色溶液,变蓝色和水有关,故C不选;
D.氯离子和硝酸银反应生成氯化银白色沉淀,与氯水成分有关,故D不选;
故选B.
点评 本题考查氯气的性质,侧重于氯水的组成和性质的考查,为高频考点,难度大不,注意把握相关物质的性质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列性质中,不能说明乙酸是弱电解质的是( )
①乙酸溶液能导电
②常温时,0.1mol/L乙酸溶液的pH约为3
③乙酸能和碳酸钙反应放出CO2
④10mL 1mol/L乙酸溶液与10mL 1mol/L的NaOH溶液恰好完全反应
⑤同pHH的盐酸和乙酸分别与足量铁片反应,乙酸产生H2多
⑥pH=1的醋酸溶液用水稀释1000倍后,pH<4.
①乙酸溶液能导电
②常温时,0.1mol/L乙酸溶液的pH约为3
③乙酸能和碳酸钙反应放出CO2
④10mL 1mol/L乙酸溶液与10mL 1mol/L的NaOH溶液恰好完全反应
⑤同pHH的盐酸和乙酸分别与足量铁片反应,乙酸产生H2多
⑥pH=1的醋酸溶液用水稀释1000倍后,pH<4.
| A. | ①②③ | B. | ④⑤⑥ | C. | ①③④ | D. | ②③④ |
18.下表是不同温度下水的离子积常数:
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11,此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀_此空删去其主要原因是(用离子方程式表示)HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-_.
(4)含有Cr2O${\;}_{7}^{2-}$的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O${\;}_{7}^{2-}$.为使废水能达标排放,做如下处理:Cr2O${\;}_{7}^{2-}$$→_{H+}^{绿矾}$Cr3+、Fe3+$\stackrel{石灰水}{→}$Cr(OH)3、Fe(OH)3.欲使10L该废水中的Cr2O${\;}_{7}^{2-}$完全转化为
Cr3+,则理论上需要加入83.4 g FeSO4•7H2O.若处理后的废水中残留的c(Fe3+)=2×10-13 mol•L-1,则残留的Cr3+的浓度为3×10-6 mol•L-1(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31).
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11,此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀_此空删去其主要原因是(用离子方程式表示)HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-_.
(4)含有Cr2O${\;}_{7}^{2-}$的废水毒性较大,某工厂废水中含5.00×10-3 mol•L-1的Cr2O${\;}_{7}^{2-}$.为使废水能达标排放,做如下处理:Cr2O${\;}_{7}^{2-}$$→_{H+}^{绿矾}$Cr3+、Fe3+$\stackrel{石灰水}{→}$Cr(OH)3、Fe(OH)3.欲使10L该废水中的Cr2O${\;}_{7}^{2-}$完全转化为
Cr3+,则理论上需要加入83.4 g FeSO4•7H2O.若处理后的废水中残留的c(Fe3+)=2×10-13 mol•L-1,则残留的Cr3+的浓度为3×10-6 mol•L-1(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31).
15.实验室制取少量干燥的氨气涉及下列装置中,其中正确的是( )
| A. | 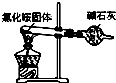 如图是氨气发生装置 | B. | 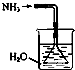 如图是氨气吸收装置 | ||
| C. | 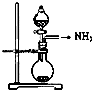 如图是氨气发生装置 | D. | 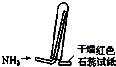 如图是氨气收集、检验装置 |
2.下列实验操作或事故处理正确的是( )
| A. | 分液时,打开分液漏斗旋转活塞,先放出下层液体,再放出上层液体 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 皮肤不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 过滤时,为了加快速度,用玻璃棒搅拌悬浊液 |
12. 如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的s区.
(2)②、⑥两元素形成的化合物的空间构型为平面正三角形,其中心原子的杂化类型为sp2.
(3)写出元素⑧基态原子的电子排布式1s22s22p63s23p63d104s1.
(4)比较:第一电离能:③<④,电负性:④<⑤(填“>”或“<”或“=”).
(5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于分子晶体(填晶体类型).
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为配位键.
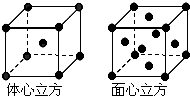
(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为2:1.
 如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题 | ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
(2)②、⑥两元素形成的化合物的空间构型为平面正三角形,其中心原子的杂化类型为sp2.
(3)写出元素⑧基态原子的电子排布式1s22s22p63s23p63d104s1.
(4)比较:第一电离能:③<④,电负性:④<⑤(填“>”或“<”或“=”).
(5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于分子晶体(填晶体类型).
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为配位键.
(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为2:1.
19.久置空气中不会因氧化还原反应而变质的物质是( )
| A. | 亚硫酸 | B. | 氯水 | C. | 氯化亚铁 | D. | 烧碱 |
16.某主族元素在周期表中的位置,取决于元素原子的( )
| A. | 相对原子质量 | B. | 电子层数和核内中子数 | ||
| C. | 电子层数和最外层电子数 | D. | 金属性和非金属性的强弱 |
9.下列物质中标“•”号的原子为sp3杂化的是( )
| A. | $\underset{\stackrel{\;}{C}}{•}$H2O | B. | $\underset{\stackrel{\;}{N}}{•}$2H4 | C. | $\underset{\stackrel{\;}{B}}{•}$F3 | D. | $\underset{\stackrel{\;}{C}}{•}$2H4 |