题目内容
4.美丽的海南岛四面环海,蕴藏着丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务.如图是海水资源综合利用的示意图.请回答: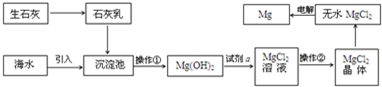
提示:MgO的熔点为2852℃,无水MgCl2的熔点为714℃.
(1)操作①的名称是过滤,操作②的名称加热浓缩、冷却结晶、过滤洗涤,在氯化氢气流中加热失水.
(2)试剂a的名称是盐酸.
(3)海水中含有K+、Na+、Mg2+等阳离子,从离子反应的角度思考,在沉淀池中向母液中加入石灰乳所发生的反应方程式为Mg2++Ca(OH)2═Mg(OH)2+Ca2+.
(4)石灰乳是生石灰与水作用形成的化合物,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是贝壳(或牡蛎壳等);
(5)用氯化镁电解生产金属镁的化学方程式为:MgCl2(熔融) $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,可见用电解法冶炼金属镁的反应是(填“是”或“不是”)氧化还原反应.
(6)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是MgO熔点很高,熔融时耗费大量的能量而增加生产成本.
分析 海水提镁的主要流程分析可知,生石灰和水反应生成石灰乳,海水引入沉淀池加入石灰乳,利用氢氧化钙沉淀镁离子生成氢氧化镁沉淀,过滤得到氢氧化镁沉淀,加入盐酸溶液溶解得到氯化镁溶液,通过蒸发浓缩冷却结晶得到氯化镁晶体,在氯化氢气流中加热失水得到固体氯化镁,通电电解氯化镁得到镁合氯气,
(1)操作①是分离氢氧化镁沉淀,操作②加热浓缩、冷却结晶、过滤洗涤;
(2)试剂a是盐酸,用来溶解氢氧化镁得到氯化镁溶液;
(3)根据镁离子能与氢氧根离子反应生成沉淀来确定氢氧化钙的作用;
(4)根据海洋产品中与石灰石相同的物质进行解答;
(5)无水MgCl2在熔融状态下,通电后阳极氯离子失去电子生成氯气,阴极镁离子得到电子生成镁单质,发生氧化还原反应;
(6)氧化镁熔点为2852℃,无水MgCl2的熔点为714℃,MgO熔点很高,熔融时耗费大量的能量而增加生产成本.
解答 解:海水提镁的主要流程分析可知,生石灰和水反应生成石灰乳,海水引入沉淀池加入石灰乳,利用氢氧化钙沉淀镁离子生成氢氧化镁沉淀,过滤得到氢氧化镁沉淀,加入盐酸溶液溶解得到氯化镁溶液,通过蒸发浓缩冷却结晶得到氯化镁晶体,在氯化氢气流中加热失水得到固体氯化镁,通电电解氯化镁得到镁合氯气,
(1)分析可知操作①是分离氢氧化镁沉淀用过滤方法分离,操作②是溶液中得到溶质固体,需要加热浓缩、冷却结晶、过滤洗涤,得到氯化镁晶体在氯化氢气流中加热失水得到固体氯化镁,
故答案为:过滤;加热浓缩、冷却结晶、过滤洗涤,在氯化氢气流中加热失水;
(2)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,加入的足量试剂a是HCl,所以试剂a是盐酸,用来溶解氢氧化镁得到氯化镁溶液,
故答案为:盐酸;
(3)镁离子能与氢氧根离子反应生成氢氧化镁沉淀:Mg2++Ca(OH)2═Mg(OH)2+Ca2+,写离子方程式时氢氧化镁沉淀写化学式,
故答案为:Mg2++Ca(OH)2═Mg(OH)2+Ca2+;
(4)贝壳或牡蛎壳的主要成分为碳酸钙,故答案为:贝壳(或牡蛎壳等);
(5)无水MgCl2在熔融状态下,通电后阳极氯离子失去电子生成氯气,阴极镁离子得到电子生成镁单质,所以氯化镁电解会产生Mg和Cl2,
故答案为:MgCl2(熔融) $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;是;
(6)氧化镁熔点为2852℃,无水MgCl2的熔点为714℃,MgO熔点很高,熔融时耗费大量的能量而增加生产成本,
故答案为:MgO熔点很高,熔融时耗费大量的能量而增加生产成本.
点评 本题考查了从海水中提取镁的反应原理,利用所学知识结合流程图信息是解答本题的关键,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 水煤气,电能是一级能源 | |
| B. | 天然气,水力是二级能源 | |
| C. | 核能,煤,石油符合未来新能源标准 | |
| D. | 太阳能,生物质能,风能,氢能符合未来新能源标准 |
| A. | 盐酸 | B. | 液态氯化氢 | C. | 干冰 | D. | 氯化钠晶体 |
| A. | 金属钠着火时,可用水或泡沫灭火器灭火 | |
| B. | 碱金属单质都可保存在煤油中 | |
| C. | 钠离子半径比钠原子半径小 | |
| D. | 碱金属中密度最小,熔、沸点最高的是铯 |
| A. | 向饱和的硫酸铵溶液中滴加蛋清溶液 | |
| B. | 日本核电站工作人员给核电机组注水降温 | |
| C. | 炼油厂蒸馏原油获得汽油、煤油等产品 | |
| D. | 露置于空气中的镁带表面逐渐变黑 |
| A. | 己烷 | B. | 四氯化碳 | C. | NaOH溶液 | D. | 裂化汽油 |

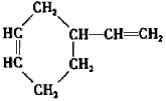 .
.