题目内容
氢化亚铜(CuH)是一种难溶的物质,用铜或铜的某些化合物和“另一物质A”在一定条件下反应可生成它.CuH 不稳定易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下可发生反应2Cu+═Cu2++Cu.根据以上信息,结合自己所掌握的知识,回答下列问题:
(1)在溶液和“另一物质A”制CuH 的反应中,用氧化还原观点分析,这“另一物质A”在反应中所起的作用是 (填氧化剂或还原剂).若A的化学式为NH5,它所有原子最外层电子都达到稀有气体的稳定结构,它的电子式为 ,A溶于水后,溶液显 (填酸性、碱性、中性).
(2)写出CuH在氯气中燃烧的化学方程式 .
(3)CuH溶解在稀HCl中,产生的现象有 .
(4)如果把CuH溶解在足量的稀硝酸中产生的气休只有NO,请写出反应的离子方程式 .
(1)在溶液和“另一物质A”制CuH 的反应中,用氧化还原观点分析,这“另一物质A”在反应中所起的作用是
(2)写出CuH在氯气中燃烧的化学方程式
(3)CuH溶解在稀HCl中,产生的现象有
(4)如果把CuH溶解在足量的稀硝酸中产生的气休只有NO,请写出反应的离子方程式
考点:铜金属及其重要化合物的主要性质,氧化还原反应
专题:信息给予题
分析:(1)根据化合价的变化判断氧化剂、还原剂;NH5在所有原子都达到稀有气体的稳定结构,说明NH5是由NH4+和H-组成的离子化合物;NH5溶于水会与水反应生成氨水;
(2)CuH在氯气中燃烧,氯气做氧化剂,CuH做还原剂;
(3)CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,再根据Cu+在酸性条件下可发生反应2Cu+═Cu2++Cu,所以反应为2CuH+2H+=Cu2++Cu+2H2↑;
(4)Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,能和铜反应生成一氧化氮气体.
(2)CuH在氯气中燃烧,氯气做氧化剂,CuH做还原剂;
(3)CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,再根据Cu+在酸性条件下可发生反应2Cu+═Cu2++Cu,所以反应为2CuH+2H+=Cu2++Cu+2H2↑;
(4)Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,能和铜反应生成一氧化氮气体.
解答:
解:(1)根据化合价的变化判断,CuSO4做氧化剂、所以另一物质做还原剂,NH5在所有原子都达到稀有气体的稳定结构,即氮原子最外层达到8电子稳定结构,所有氢原子达到2电子稳定结构,说明NH5是由NH4+和H-组成的离子化合物,电子式为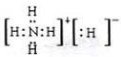 ,NH5溶于水会与水反应生成氨水,所以溶液呈碱性;
,NH5溶于水会与水反应生成氨水,所以溶液呈碱性;
故答案为:还原剂;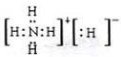 ;碱性;
;碱性;
(2)CuH在氯气中燃烧,氯气做氧化剂,CuH做还原剂,所以反应方程式为:2CuH+3Cl2
2CuCl2+2HCl,
故答案为:2CuH+3Cl2
2CuCl2+2HCl;
(3)CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,再根据Cu+在酸性条件下可发生反应2Cu+═Cu2++Cu,所以反应为2CuH+2H+=Cu2++Cu+2H2↑;
故答案为:生成红色沉淀和无色气体,溶液变蓝色;
(4)Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,CuH具有还原性,二者反应生成一氧化氮气体、铜离子、H2O,
故答案为:CuH+3H++NO3-=Cu2++2H2O+NO↑.
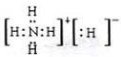 ,NH5溶于水会与水反应生成氨水,所以溶液呈碱性;
,NH5溶于水会与水反应生成氨水,所以溶液呈碱性;故答案为:还原剂;
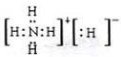 ;碱性;
;碱性;(2)CuH在氯气中燃烧,氯气做氧化剂,CuH做还原剂,所以反应方程式为:2CuH+3Cl2
| ||
故答案为:2CuH+3Cl2
| ||
(3)CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,再根据Cu+在酸性条件下可发生反应2Cu+═Cu2++Cu,所以反应为2CuH+2H+=Cu2++Cu+2H2↑;
故答案为:生成红色沉淀和无色气体,溶液变蓝色;
(4)Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu,稀硝酸具有强氧化性,CuH具有还原性,二者反应生成一氧化氮气体、铜离子、H2O,
故答案为:CuH+3H++NO3-=Cu2++2H2O+NO↑.
点评:本题属于信息给予题,筛选有用信息结合已学知识进行整合处理,难度较大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
下列有关分散系的叙述正确的是( )
| A、Al(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
| B、悬浊液中一定不含直径小于10-9m的微粒 |
| C、胶体区别于其他分散系的本质特征是胶体可发生丁达尔效应 |
| D、食盐溶液静置后会分层,下层比上层咸 |
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A、反应后溶液中不存在任何沉淀,所以反应前后Cu2的浓度不变 |
| B、沉淀溶解后,深蓝色的溶液为[Cu(NH3)4](OH)2 |
| C、在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子NH3提供空轨道 |
| D、用硝酸铜溶液代替硫酸铜溶液进行实验,能观察到同样的现象 |
已知氧化性Fe3+>I2.FeI2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++bI-+c Cl2→d Fe3++e I2+f Cl-下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A、2 4 3 2 2 6 |
| B、0 2 1 0 1 2 |
| C、2 0 1 2 0 2 |
| D、2 10 6 2 5 12 |
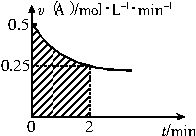 某溶液中发生反应A
某溶液中发生反应A| 无 |
| 无 |
| A、反应开始的前2min,A的平均反应速率小于0.375mol?L-1?min-1 |
| B、图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值 |
| C、图中阴影部分的面积表示0~2min内A的物质的量的减小值 |
| D、至2min时,B的物质的量浓度c(B)介于1~1.5mol?L-1之间 |
在某100mL混合酸中,硝酸物质的量浓度为0.4mol/L,硫酸物质的量浓度为0.2mol/L,向其中加入3.2g铜粉,微热,待其充分反应后,溶液中铜离子的物质的量浓度约为( )
| A、0.15mol/L |
| B、0.3mol/L |
| C、0.5mol/L |
| D、无法计算 |

 乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.