题目内容
10.如图为元素周期表的一部分,下列有关短周期元素X、Y、Z、R的叙述正确的是( )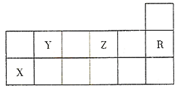
| A. | 热稳定性:Y的气态氢化物>Z的气态氢化物 | |
| B. | 简单离子半径比较Z小于X | |
| C. | X元素的单质能与所有强酸发生反应放出H2 | |
| D. | R的核外电子数与OH-的核外电子数相同 |
分析 由元素在周期表的位置可知,Y为C,Z为O,R为Ne,X为Al,
A.非金属性越强,对应氢化物越稳定;
B.具有相同电子排布的离子中,原子序数大的离子半径小;
C.Al与硝酸、浓硫酸发生氧化还原反应不生成氢气;
D.R的核外电子数与OH-的核外电子数均为10.
解答 解:由元素在周期表的位置可知,Y为C,Z为O,R为Ne,X为Al,
A.非金属性越强,对应氢化物越稳定,则热稳定性:Z的气态氢化物>Y的气态氢化物,故A错误;
B.具有相同电子排布的离子中,原子序数大的离子半径小,则简单离子半径比较Z大于X,故B错误;
C.Al与硝酸、浓硫酸发生氧化还原反应不生成氢气,与稀硫酸、盐酸反应生成氢气,故C错误;
D.R的核外电子数与OH-的核外电子数均为10,二者核外电子数相同,故D正确;
故选D.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
1.下列制备物质的工业生产流程合理的是( )
| A. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{电解}{→}$Mg | |
| B. | 由NaCl制漂白剂:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| C. | 由铝土矿冶炼铝:铝土矿$→_{Na_{3}AlF_{6}}^{电解}$Al | |
| D. | 合成NH3:NH4Cl和Ca(OH)2固体$\stackrel{△}{→}$NH3$\stackrel{碱石灰}{→}$纯净干燥的氨气 |
18.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. | 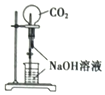 喷泉实验 | B. |  配制一定物质的量浓度的NaCl溶液 | ||
| C. | 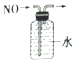 排水法收集NO | D. |  碳酸氢钠受热分解 |
19.下列说法正确的是( )
| A. | 向碳酸氢钠溶液中加入氢氧化钙溶液时,溶液没有浑浊 | |
| B. | 夏日的傍晚常常看到万丈霞光,该现象属于胶体的丁达尔效应 | |
| C. | 过氧化钠是一种强氧化剂,不可作为氧气来源 | |
| D. | 胶体和浊液的分散质都不能通过滤纸的孔隙 |
1.向1LFeBr2溶液中,通入1.12L的Cl2,测得溶液中c(Br-)=3c(Cl-),反应过程中溶液的体积变化不计,则下列说法中正确的是( )
| A. | 原溶液的浓度为0.1mol/L | B. | 反应后溶液中c(Fe3+)=0.1mol/L | ||
| C. | 反应后溶液中c(Fe3+)=c(Fe2+) | D. | 原溶液中c(Br-)=0.4mol/L |
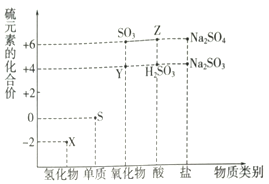 利用元素的化合价推测物质的性质是化学研究的重要手段.
利用元素的化合价推测物质的性质是化学研究的重要手段. 根据下列电化学装置,回答下列问题:
根据下列电化学装置,回答下列问题:


