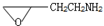题目内容
17.下列说法不正确的是( )| A. | 广泛pH试纸和精密pH试纸测量的精密度不同,测量的范围相同 | |
| B. | 用NaOH标准溶液滴定CH3COOH溶液至中性时,溶液中的酸未被完全中和 | |
| C. | 将等体积等物质的量浓度的弱酸HA与NaA混合,所得混合液的酸碱性取决于Ka(HA)的大小 | |
| D. | 等物质的量的NaClO、NaHCO3混合溶液中存在如下关系:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+c(CO32-) |
分析 A.广泛PH试纸测量范围1-14,精密pH范围有很多种;
B.用NaOH标准溶液滴定CH3COOH溶液恰好反应生成醋酸钠,醋酸根离子水解显碱性,若至中性时,酸需要过量;
C.Ka(HA)越大,酸性越强;
D.溶液中存在物料守恒,n(Cl)=n(C).
解答 解:A.精密pH试纸可精确至0.1,广泛pH试纸可精确至1,测量的范围不相同,故A错误;
B.用NaOH标准溶液滴定CH3COOH溶液恰好反应生成醋酸钠,醋酸根离子水解显碱性,若至中性时,酸需要过量,溶液中的酸未被完全中和,故B正确;
C.Ka(HA)越大,酸性越强,如HA电离程度大于A-水解程度,则溶液呈酸性,否则呈碱性,故C正确;
D.溶液中存在物料守恒c(HClO)+c(ClO-)═c(HCO3-)+c(CO32-)+c(H2CO3)=0.5c(Na+),所以得c(HClO)+c(ClO-)═c(HCO3-)+c(CO32-)+c(H2CO3),故D正确;
故选A.
点评 本题考查离子浓度大小比较,弱电解质电离平衡影响因素分析,注意醋酸和氢氧化钠溶液中和反应后溶液显中性,溶液中的溶质是两种,溶液中存在电荷守恒和物料守恒,根据守恒思想解答,题目难度中等,属于易错题.

练习册系列答案
相关题目
7.下列实验中能达到实验目的是( )
| A. |  用装置氧化废液中的溴化氢 | B. |  量取100.00mL溶液 | ||
| C. |  将萃取液中的苯与碘进行分离 | D. |  灼烧熔融碳酸钠固体 |
8.仪器名称为“容量瓶”的是( )
| A. |  | B. |  | C. |  | D. |  |
5.某无色透明的溶液,在强酸性和强碱性的条件下都能大量共存的是( )
| A. | Fe2+、K+、SO42-、HCO3- | B. | Mg2+、Na+、SO42-、Cl- | ||
| C. | Na+、K+、SO42-、NO3- | D. | Ba2+、Na+、MnO4-、SO42- |
12.下列有关化学药品的存放说法不正确的是( )
| A. | 液溴易挥发,实验室常用水液封并密封保存 | |
| B. | 金属钠遇到氧气立即反应,常保存在煤油中 | |
| C. | 浓硫酸有强腐蚀性,常温时不可用铁质容器贮运 | |
| D. | 硅酸钠溶液应用带橡胶塞的细口瓶保存 |
9.水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O.下列说法中正确的是( )
| A. | x=2 | |
| B. | 参加反应的Fe2+全部作还原剂 | |
| C. | 每生成1molFe3O4,反应转移电子的总物质的量为4mol电子 | |
| D. | 1molFe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol |
4.将pH为9的NaOH溶液与pH为11的NaOH溶液等体积混合后,所得的溶液中氢离子浓度最接近于( )
| A. | $\frac{1}{2}$(10-9+10-11) mol•L-1 | B. | 2×10-11mol•L-1 | ||
| C. | (1×10-14-5×10-4) mol•L-1 | D. | (10-9+10-11) mol•L-1 |
5.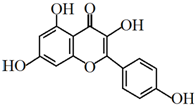 山萘酚(Kaempf erol)结构如图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用.下列有关山萘酚的叙述正确的是( )
山萘酚(Kaempf erol)结构如图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用.下列有关山萘酚的叙述正确的是( )
 山萘酚(Kaempf erol)结构如图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用.下列有关山萘酚的叙述正确的是( )
山萘酚(Kaempf erol)结构如图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用.下列有关山萘酚的叙述正确的是( )| A. | 结构式中含有羟基、醚键、酯基、碳碳双键 | |
| B. | 可发生取代反应、水解反应、加成反应 | |
| C. | 可与NaOH反应,不能与NaHCO3反应 | |
| D. | 1 mol山萘酚与溴水反应最多可消耗4 mol Br2 |
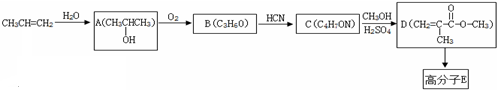
 .
.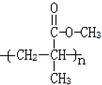 .
.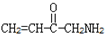 B.CH3CH2-N=CHCH2OH C.
B.CH3CH2-N=CHCH2OH C.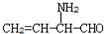 D.
D.