题目内容
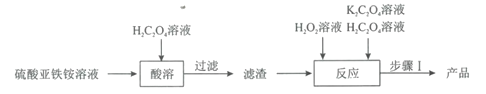
【题目】草酸合铁(III)酸钾晶体[K3[Fe(C2O4)3]·3H2O]是制备负载型活性铁催化剂的主要原料。某科研团队以硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]为原料制备草酸合铁(III)酸钾晶体的具体流程如图:
回答下列问题:
(1)配制100mL1.00mol·L-1的硫酸亚铁铵溶液。溶液配制过程中需用到的玻璃仪器除烧杯、玻璃棒、量筒外,还有___。在配制时需加入适量稀硫酸的目的是___。
(2)取12.5mL硫酸亚铁铵溶液于烧杯中,水浴加热至100℃,缓缓滴入饱和H2C2O4溶液,有黄色沉淀(FeC2O4·2H2O)生成,反应的离子方程式为___。
(3)在“酸溶”操作中,需保持溶液的pH为3.5,溶液中![]() =___。(H2C2O4的Ka1=10-1.25,Ka2=10-4.27)。
=___。(H2C2O4的Ka1=10-1.25,Ka2=10-4.27)。
(4)在“反应”中,先维持40℃水浴加热,滴加10mL6%H2O2溶液,一段时间后,再微沸2min;然后冷却,继续交替滴加H2C2O4和K2C2O4溶液直至溶液呈亮绿色。维持40℃水浴加热使最终所得产品产率最高的原因是__,溶液微沸的目的是__。
(5)经“步骤I”结晶、抽滤、洗涤、避光干燥,最终得到产品5.45g,产品的产率为____(保留1位小数)。
(6)草酸合铁(I)酸钾晶体为光敏配合物,应避光保存,光照时会发生光化学分解反应生成草酸钾和草酸亚铁,同时有气体生成,反应的化学方程式为___。
【答案】胶头滴管、100mL容量瓶 防止Fe2+和NH![]() 水解 Fe2++H2C2O4=FeC2O4↓+2H+ 101.48 低于40℃氧化反应速率太慢,高于40℃H2O2易分解 除去过量的H2O2 88.8% K3[Fe(C2O4)3]3H2O
水解 Fe2++H2C2O4=FeC2O4↓+2H+ 101.48 低于40℃氧化反应速率太慢,高于40℃H2O2易分解 除去过量的H2O2 88.8% K3[Fe(C2O4)3]3H2O![]() 2K2C2O4+2FeC2O4+2CO2↑+6H2O
2K2C2O4+2FeC2O4+2CO2↑+6H2O
【解析】
硫酸亚铁铵溶液在草酸的作用下,可溶解,再在过氧化氢的作用下,亚铁离子被氧化为铁离子,最终经过洗涤、干燥得到晶体。
(1)配制100mL的硫酸亚铁铵溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒、100mL容量瓶,胶头滴管;加入硫酸,提供酸性环境,可防止Fe2+和NH![]() 水解;
水解;
(2)硫酸亚铁铵溶液,水浴加热至100℃,滴入饱和H2C2O4溶液,有黄色沉淀(FeC2O4·2H2O)生成,反应的离子方程式为:Fe2++H2C2O4=FeC2O4↓+2H+;
(3)已知H2C2O4的 ,
, ,又该溶液的pH为3.5,则溶液中
,又该溶液的pH为3.5,则溶液中![]() ;
;
(4)在“反应”中,先维持40℃水浴加热,滴加10mL6%H2O2溶液,一段时间后,再微沸2min;维持40℃水浴加热的原因是低于40℃氧化反应速率太慢,高于40℃时H2O2易分解;溶液微沸的目的是除去过量的H2O2;
(5)草酸合铁(III)酸钾晶体[K3[Fe(C2O4)3]·3H2O]由12.5mL1.00mol·L-1的硫酸亚铁铵溶液制得,二者是1:1的关系,则草酸合铁(III)酸钾晶体的理论产量为![]() ,产品的产率为
,产品的产率为![]() ;
;
(6)草酸合铁(I)酸钾晶体光照时会发生光化学分解反应生成草酸钾和草酸亚铁,同时有气体生成,反应的化学方程式为:K3[Fe(C2O4)3]3H2O![]() 2K2C2O4+2FeC2O4+2CO2↑+6H2O。
2K2C2O4+2FeC2O4+2CO2↑+6H2O。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案