题目内容
室温下,单质A、B、C分别为固体、黄绿色气体与无色气体,在合适条件下,它们可以按如图的流程进行反应.又知E溶液是无色的.请回答:

(1)写出E物质的化学式 ,B物质电子式 .
(2)写出G→H的化学方程式 .
(3)写出B+F→D的离子方程式 .

(1)写出E物质的化学式
(2)写出G→H的化学方程式
(3)写出B+F→D的离子方程式
考点:无机物的推断
专题:推断题
分析:由B为黄绿色气体且为单质,可知B为Cl2;固体单质A与Cl2反应生成的D为一种氯化物;Cl2与气体单质C生成E为氯化物,且E的溶液时无色的,E溶液和固体单质A又可以重新生成气体C和F,E溶液应为酸,可推知C为氢气、E为HCl,F能与氯气反应得到D,A为变价金属,应是Fe,故F为FeCl2,D为FeCl3,G为Fe(OH)2,H为Fe(OH)3,根据对应物质的性质解答该题.
解答:
解:由B为黄绿色气体且为单质,可知B为Cl2;固体单质A与Cl2反应生成的D为一种氯化物;Cl2与气体单质C生成E为氯化物,且E的溶液时无色的,E溶液和固体单质A又可以重新生成气体C和F,E溶液应为酸,可推知C为氢气、E为HCl,F能与氯气反应得到D,A为变价金属,应是Fe,故F为FeCl2,D为FeCl3,G为Fe(OH)2,H为Fe(OH)3,
(1)由上述分析可知,E为HCl,B为Cl2,其电子式为: ,故答案为:HCl;
,故答案为:HCl; ;
;
(2)G→H的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)B+F→D的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
(1)由上述分析可知,E为HCl,B为Cl2,其电子式为:
 ,故答案为:HCl;
,故答案为:HCl; ;
;(2)G→H的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)B+F→D的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评:本题考查无机物的推断,涉及Fe、Cl元素单质及其化合物性质等,注意根据物质的颜色作为突破口,需要学生熟练掌握元素化合物知识,再结合转化关系推断,难度不大.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
下列说法正确的是( )
| A、得到电子的物质是氧化剂,氧化剂发生还原反应,表现出氧化性 |
| B、工业上可通过电解饱和食盐水制得金属钠 |
| C、红热的铁丝在氯气中剧烈燃烧产生大量的白烟 |
| D、干燥的氯气有漂白性,还能用作杀菌消毒剂 |
下列实验装置、试剂选用或操作正确的是( )
A、 干燥Cl2 |
B、 除去CO2中的HCl |
C、 稀释浓硫酸 |
D、 制取少量氨气 |

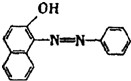 2005年4月10日,中央电视台发布“每周质量报告”,全国共有18个省市30家企业的88种食品样品中都检出了致癌物工业用染料“苏丹红I号”.苏丹红I号结构如图所示:
2005年4月10日,中央电视台发布“每周质量报告”,全国共有18个省市30家企业的88种食品样品中都检出了致癌物工业用染料“苏丹红I号”.苏丹红I号结构如图所示: