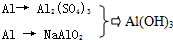题目内容
15.图表示4个碳原子相互结合的方式,小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.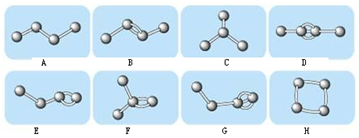
(1)图中属于烷烃的是AC(填编号),属于烯烃的是BEF(填编号)
(2)图中与B互为同分异构体但不属于同种类的物质的是H(填编号)
分析 (1)按照碳碳间成键方式烃可分为烷烃、烯烃、炔烃,烷烃只含单键,烯烃含有碳碳双键,炔烃含有碳碳三键.烷烃是只有碳碳单键和碳氢键的链烃,是最简单的一类有机化合物;烯烃是指含有C=C键(碳-碳双键)(烯键)的碳氢化合物;炔烃是分子中含有碳碳三键的碳氢化合物;
(2)同分异构体是分子式相同而结构不同的有机物之间的互称;
解答 解:(1)根据烷烃、烯烃、炔烃的定义可知AC属于烷烃,BEF属于烯烃,DG属于炔烃,H属于环烷烃;
故答案为:AC;BEF;
(2)B是2-丁烯,其分子式为C4H8,与B互为同分异构体但不属于同种类的物质的是环丁烷,
故答案为:H;
点评 本题考查了学生对信息的理解运用、读图能力,难度不大,加深对同分异构体概念的理解.

练习册系列答案
相关题目
13.可逆反应在一定条件下达到化学平衡时,下列说法错误的是( )
| A. | 正反应速率等于逆反应速率 | B. | 反应物和生成物浓度不再发生变化 | ||
| C. | 正、逆反应速率都为零 | D. | 反应体系中混合物的组成保持不变 |
20.下列说法不正确的是( )
| A. | CH3-CH═CH2和CH2═CH2的最简式相同 | |
| B. | 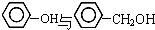 相差一个CH2,互为同系物 相差一个CH2,互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的乙炔、苯、苯乙烯(C8H8)分别完全燃烧,耗氧量相等 |
7.为解决能源危机,在汽油中掺入一定比例的乙醇(即乙醇汽油),以代替一部分汽油,乙醇在汽缸中完全燃烧的热化学方程式为:$\frac{1}{2}$C2H5OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+$\frac{3}{2}$H2O(l)△H=-683.4KJ/mol.下列说法正确的是( )
| A. | 该反应中,生成物的总能量大于反应物的总能量 | |
| B. | 该反应中,断裂化学键会放出能量 | |
| C. | 乙醇的燃烧热为683.4KJ/mol | |
| D. | 反应$\frac{1}{2}$C2H5OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+$\frac{3}{2}$H2O(g)△H>-683.4KJ/mol |
 最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH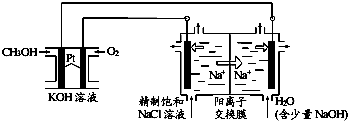
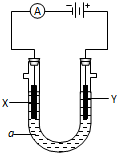 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 请回答以下问题: 甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.
甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.