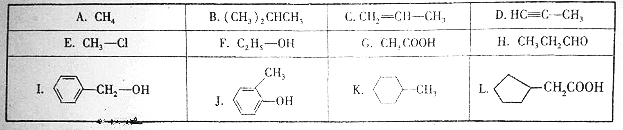
题目内容
18.A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如图(部分产物已略去):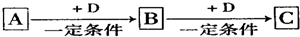
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为Na(填元素符号)
(2)若D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程式表示)加入少量铁,防止Fe2+被氧化为Fe3+2Fe3++Fe=3Fe2+;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式O2+2H2O+4e-=4OH-.
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.请写出B转化为C的所有可能的离子方程式Al(OH)3+3H+=Al3++3H2O或Al(OH)3+OH-=AlO2-+2H2O.
分析 (1)D是具有氧化性的单质,A元素属于短周期主族金属元素,根据反应关系可知A为Na,B为Na2O,D为O2,C为Na2O2;
(2)若D是金属.说明金属具有变价,A稀溶液具有氧化性,推断为:HNO3→Fe(NO3)3→Fe(NO3)2,D为Fe,因Fe(NO3)2易被氧化而变质,可加入铁防止被氧化生成硝酸铁,铁在潮湿的空气中易发生吸氧腐蚀,发生腐蚀时原电池正极是氧气获得电子变为OH-;
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.判断为:Al3+→Al(OH)3→AlO2-; B转化为C的所有可能的离子方程式为生成氢氧化铝沉淀,氢氧化铝是两性氢氧化物溶液强酸强碱.
解答 解:(1)D是具有氧化性的单质,A元素属于短周期主族金属元素,根据反应关系可知A为Na,B为Na2O,D为O2,C为Na2O2,发生的反应为:4Na+O2=2Na2O,2Na2O+O2=2Na2O2,故答案为:Na;
(2)若D是金属.说明金属具有变价,A稀溶液具有氧化性,推断为:HNO3→Fe(NO3)3→Fe(NO3)2,D为Fe,因Fe(NO3)2易被氧化而变质,可加入铁防止被氧化生成硝酸铁,离子方程式为2Fe3++Fe=3Fe2+,铁在潮湿的空气中易发生吸氧腐蚀,发生腐蚀时原电池正极是氧气获得电子变为OH-,该的电极反应式为O2+2H2O+4e-=4OH-,
故答案为:加入少量铁,防止Fe2+被氧化为Fe3+,2Fe3++Fe=3Fe2+;O2+2H2O+4e-=4OH-;
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.判断为:Al3+→Al(OH)3→AlO2-; B转化为C的所有可能的离子方程式为生成氢氧化铝沉淀,在酸溶解的离子方程式是:Al(OH)3+3H+=Al3++3H2O,或碱中Al(OH)3溶解反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
故答案为:Al(OH)3+3H+=Al3++3H2O或 Al(OH)3+OH-=AlO2-+2H2O;
点评 本题考查了无机物的转化关系、物质性质、反应的离子方程式和反应现象等知识点,掌握基础是解题关键,题目难度中等.

| A. | 某广告语:本饮料含淀粉,糖尿病人可以大量食用 | |
| B. | 到城乡结合处燃放鞭炮,可避免污染环境 | |
| C. | 淡水资源在地球上分布很广,取之不尽,用之不竭 | |
| D. | 大气中二氧化碳含量的增多是造成“温室效应”的主要原因 |
| A. | 淀粉、蛋白质和油脂都是高聚物,在一定条件下都能水解 | |
| B. | 在有机物分子中,含有的氢原子个数一定是偶数 | |
| C. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 | |
| D. | 用溴水可以鉴别己烯、己烷、四氯化碳三种有机物 |
| A. | 在标况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA | |
| B. | 常温常压下,16gO3所含的电子数为8NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA | |
| D. | 铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA |
 ,反应类型取代反应.
,反应类型取代反应.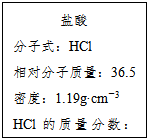 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: