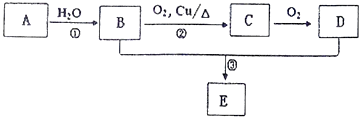
题目内容
【题目】在反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是 , 氧化产物是 , 氧化产物与还原产物物质的量之比是 , 被氧化与未被氧化的HCl的质量之比为 , 若有7.3g HCl被氧化,则产生Cl2的质量为g,转移的电子数为mol.
【答案】KMnO4;Cl2;5:2;5:3;7.1;0.2.
【解析】2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由﹣1价升高为0,则KMnO4为氧化剂,被还原,还原产物为MnCl2;HCl为还原剂,被氧化,所以Cl2为氧化产物,氧化产物与还原产物物质的量之比是5:2,16molHCl中10mol作还原剂被氧化,则被氧化与未被氧化的HCl的质量之比为10mol:6mol=5:3,若有7.3g HCl被氧化,n(HCl)= ![]() =0.2mol,由Cl原子守恒可知生成氯气的质量为0.2mol×35.5g/mol=7.1g,转移电子为0.2mol×[0﹣(﹣1)]=0.2mol。
=0.2mol,由Cl原子守恒可知生成氯气的质量为0.2mol×35.5g/mol=7.1g,转移电子为0.2mol×[0﹣(﹣1)]=0.2mol。
故答案为:KMnO4,Cl2,5:2,5:3,7.1,0.2.
在氧化还原反应中,反应物元素化合价升高的是还原剂,发生氧化反应,被氧化,对应产物是氧化产物;反应物元素化合价降低的是氧化剂,发生还原反应,被还原,对应产物是还原产物;根据化学反应方程式转移的电子数来计算转移的电子数。

【题目】烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3 ![]() 7N2+12H2O
7N2+12H2O
① 上述反应中被还原的元素是(填元素符号),反应中每转移3mol电子,生成标准状况下N2的体积为;
② 超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ 、O3 ![]() O+O2 Ⅱ 、NO+O3→NO2+O2Ⅲ 、 NO2+O→ NO+O2
O+O2 Ⅱ 、NO+O3→NO2+O2Ⅲ 、 NO2+O→ NO+O2
上述反应中NOx所起的作用是;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
方法Ⅰ | 用氨水将SO2转化为NH4HSO3 , 再氧化成(NH4)2SO4 |
方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
①方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3 , 是利用了SO2的性质(选填字母编号)。
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物
②方法Ⅰ中氨水吸收燃煤烟气中SO2的化学反应为:2NH3+SO2+H2O=(NH4)2SO3
(NH4)2SO3+SO2+H2O=2NH4HSO3 , 能提高燃煤烟气中SO2去除率的措施有(填字母). A.增大氨水浓度 B.升高反应温度C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
③采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的CO2 , 原因是(用离子方程式表示)。
【题目】以铝灰(主要成分为Al、Al2O3 , 另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝[Alm(OH)nCl3m﹣n],生产的部分过程如图所示(部分产物和操作已略去). 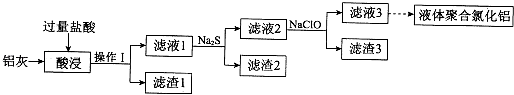
已知某些硫化物的性质如下表:
物质 | 性质 |
Fe2S3 Al2S3 | 在水溶液中不存在 |
FeS | 黑色,难溶于水,可溶于盐酸 |
CuS | 黑色,难溶于水,难溶于盐酸 |
(1)操作I是 . Al2O3与盐酸反应的离子方程式是 .
(2)滤渣2为黑色,该黑色物质的化学式是 .
(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7.NaClO的作用是 .
(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝.反应的化学方程式是 .
(5)将滤液3电解也可以得到液体聚合氯化铝.装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极). 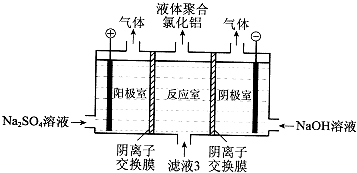
①写出阴极室的电极反应: .
②简述在反应室中生成聚合氯他铝的原理: .